Unterschied zwischen freier Radikal- und Ionenpolymerisation
Der Schlüsselunterschied zwischen freier Radikal- und Ionenpolymerisation ist das Die Polymerisation von freien Radikalen tritt durch Radikale auf, die ein ungepaartes Elektron enthalten, während eine ionische Polymerisation über ionische Spezies auftritt, die keine ungepaarten Elektronen aufweist.
Polymerisation ist der chemische Prozess der Bildung von Polymermaterialien. Ein Polymer wird aus der Kombination einer großen Anzahl von Monomereinheiten über chemische Bindungen gebildet. Es gibt drei Hauptformen der Polymerisation als Zugabe, Kondensation und radikale Polymerisation.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist freie Radikalisationspolymerisation
3. Was ist Ionenpolymerisation
4. Seite an Seitenvergleich - freie Radikale gegen ionische Polymerisation in tabellarischer Form
5. Zusammenfassung
Was ist freie Radikalisationspolymerisation?
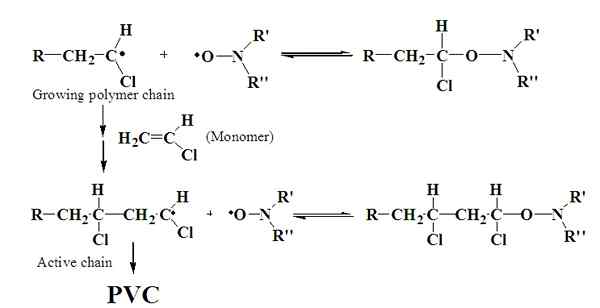
Die Polymerisation von freier Radikale ist der Prozess der Bildung eines Polymermaterials über die Zugabe von freien Radikalen. Freie Radikale können auf verschiedene Arten gebildet werden. Die häufigste Methode beinhaltet häufig ein Initiatormolekül, das ein Radikal bildet. Eine Polymerkette bildet sich aus der Zugabe des mit den nicht radikalen Monomeren erzeugten Radikalen.

Abbildung 01: Bildung des PVC -Polymers aus freier Radikalisationspolymerisation
Am radikalen Polymerisationsprozess sind drei Hauptschritte beteiligt:
- Einleitung
- Vermehrung
- Beendigung
Der Initiationsschritt erzeugt einen reaktiven Punkt. Es ist der Punkt, an dem sich die Polymerkette bildet. Der zweite Schritt ist der Ausbreitungsschritt, in dem das Polymer seine Zeit mit dem Wachstum der Polymerkette verbringt. Im Terminierungsschritt stoppt das Wachstum der Polymerkette. Das kann auf verschiedene Arten passieren:
- Kombination der Enden zweier wachsender Polymerketten
- Kombination des wachsenden Ende einer Polymerkette mit einem Initiator
- Radikale Unverhältnis (Entfernung eines Wasserstoffatoms, eine ungesättigte Gruppe)
Was ist Ionenpolymerisation?
Ionenpolymerisation ist der Prozess der Bildung eines Polymermaterials unter Verwendung ionischer chemischer Spezies als anfängliche Reaktanten. Dies ist ein Subtyp der Kettenwachstumspolymerisation; Es gibt zwei Arten von Kettenwachstumspolymerisation als ionische und radikale Polymerisation. Darüber hinaus kann die ionische Polymerisation weiter in zwei Gruppen als kationische und anionische Polymerisation unterteilt werden.
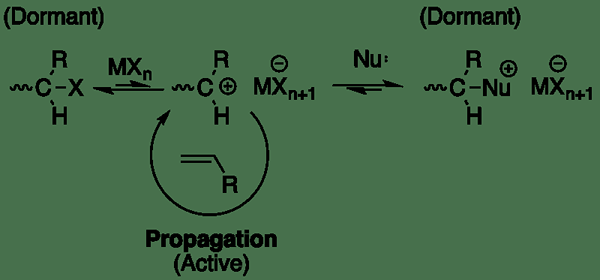
Abbildung 02: Allgemeiner Prozess der ionischen Polymerisation
Die anionische Polymerisation beginnt mit einem Anion. In dieser Art von Polymerisationsprozess können verschiedene Arten von Initiatoren verwendet werden. Es gibt drei Hauptschritte, die während des anionischen Polymerisationsprozesses stattfinden: Initiierung, Ausbreitung und Beendigung. Der Prozess wird durch nukleophile Zugabe eines Anion zu einer Doppelbindung im Monomer initiiert.
Die kationische Polymerisation beginnt mit einem Kation. Das Kation überträgt seine elektrische Ladung an das Monomer, um das Monomer zur Polymerisation zu aktivieren. Das reaktiv.
Was ist der Unterschied zwischen freier Radikal- und Ionenpolymerisation?
Freie Radikale und ionische Polymerisation sind zwei verschiedene Prozesse der Bildung eines Polymermaterials. Diese beiden sind die Subtypen der Kettenwachstumspolymerisation. Der Schlüsselunterschied zwischen freier Radikal- und Ionenpolymerisation besteht darin, dass durch Radikale, die ein ungepaartes Elektron enthalten.
Darüber hinaus macht das Radikal das Monomer in der ionischen Polymerisation bei freier Radikalisation das Monomer zu einem reaktiven Radikal.
Im Folgenden finden Sie eine Zusammenfassung des Unterschieds zwischen freier Radikal- und Ionenpolymerisation in tabellarischer Form.
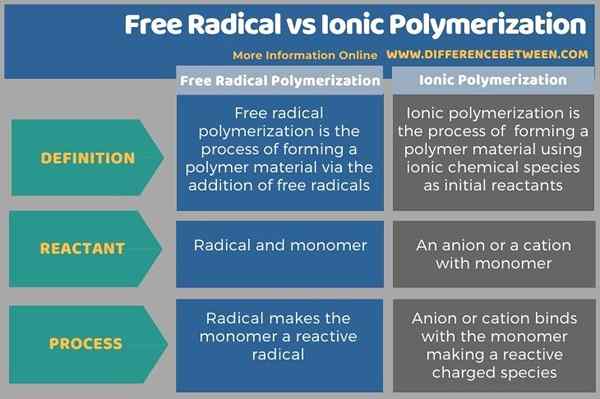
Zusammenfassung -freie Radikale gegen ionische Polymerisation
Freie Radikale und ionische Polymerisation sind zwei verschiedene Prozesse der Bildung eines Polymermaterials. Diese beiden sind die Subtypen der Kettenwachstumspolymerisation. Der Schlüsselunterschied zwischen freier Radikal- und Ionenpolymerisation besteht darin, dass durch Radikale, die ein ungepaartes Elektron enthalten.
Referenz:
1. „Polymerisation.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 6 Apr. 2016, hier erhältlich.
2. „Polymerisation.”Polymerisation - Ein Überblick | Sciencedirect -Themen, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „Mechanismus der Nitroxid -vermittelten Polymerisation für freie Radikale für PVC“ von Thilini UKWaththage - eigene Arbeit (CC BY -SA 4).0) über Commons Wikimedia
2. "Wiki Cation" von Wikichemist2013 - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia