Unterschied zwischen freien Radikalen und reaktiven Sauerstoffspezies
Der Schlüsselunterschied Zwischen freien Radikalen und reaktiven Sauerstoffspezies ist das Freie Radikale können Sauerstoffatome enthalten oder nicht, während reaktive Sauerstoffspezies im Wesentlichen Sauerstoffatome enthalten.
Wir verwenden normalerweise die Begriffe freie Radikale und reaktive Sauerstoffspezies austauschbar, da reaktive Sauerstoffspezies immer freie Radikalverbindungen sind. Allerdings sind nicht alle freien Radikale reaktive Sauerstoffspezies; Sie können Sauerstoffatome enthalten oder auch nicht, aber aufgrund des Vorhandenseins eines ungepaarten Elektrons sehr reaktiv. Daher reagieren diese beiden Formen dazu, mit geeigneten Quellen zu reagieren, um ein Elektron mit ihrem ungepaarten Elektron zu erhalten, sodass die Elektronenkonfiguration stabil wird.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind freie Radikale
3. Was sind reaktive Sauerstoffspezies
4. Seite für Seitenvergleich - Atomer Sauerstoff gegen molekulare Sauerstoffspezies in tabellarischer Form
5. Zusammenfassung
Was sind freie Radikale?
Freie Radikale sind reaktive Atome oder eine Gruppe von Atomen, die ein oder mehrere ungepaarte Elektronen enthalten. Sie sind aufgrund des Vorhandenseins eines ungepaarten Elektrons hochreaktiv. Darüber hinaus sind freie Radikale sehr instabil und neigen dazu, sich zu stabilisieren, indem sie Elektronen von außen erhalten, um leere Orbitale zu füllen. Sie reagieren mit anderen chemischen Verbindungen, um das erforderliche Elektron zu fangen. Freie Radikale sind wichtige Zwischenprodukte in natürlichen Prozessen. Wir können freie Radikale durch einen Superscript -Punkt nach rechts bezeichnen. Zum Beispiel h., Cl., Ho., H3C.
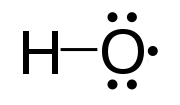
Abbildung 01: Hydroxylradikal
Langlebige freie Radikale befinden sich in drei Kategorien: stabile Radikale, anhaltende Radikale und DI-Radikale.
- Stabile Radikale: Das Hauptbeispiel für ein stabiles Radikal ist der Molekülsauerstoff o2. Organische Radikale, die konjugiertes π -System enthalten.
- Persistente Radikale: Sie sind langlebig aufgrund des sterischen Umschlag.
- DI-Radikale: Einige Moleküle haben zwei radikale Zentren; Wir nennen sie als DI-Radikale. Molekularer Sauerstoff natürlich (atmosphärischer Sauerstoff) existiert als Diradikaler.
Was sind reaktive Sauerstoffspezies
Reaktive Sauerstoffspezies sind Radikale, die hochreaktiv sind und ungepaarte Elektronen enthalten. Die Bezeichnung für diesen Begriff ist ROS. Diese chemischen Spezies enthalten im Wesentlichen Sauerstoffatome, die ein ungepaartes Elektron enthalten. Einige häufige Beispiele sind Peroxid, Superoxid, Hydroxylradikal, Alpha -Sauerstoff usw.

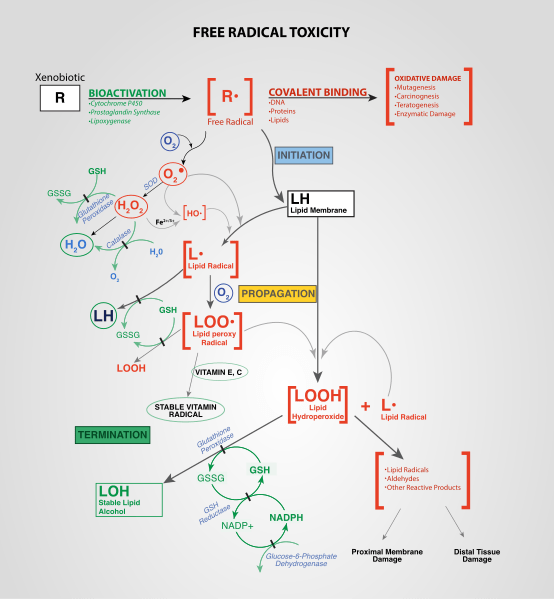
Abbildung 02: Bildung von ROS endogen
Unterschiedliche chemische Reaktionen bilden diese reaktiven Sauerstoffspezies; Beispielsweise bildet die Verringerung des molekularen Sauerstoffs Superoxid und diese reaktive Sauerstoffspezies wirkt als Vorläufer für viele andere radikale Formationen. Peroxide sind ein weiterer wichtiger ROS -Typ, der sich aus der Dismutation von Superoxid bildet.
Es gibt endogene und exogene Wege zur Herstellung von ROS. Beispielsweise bilden sich reaktive Sauerstoffspezies in verschiedenen biologischen Reaktionen in Zellen und Organellen wie Peroxisomen. Die exogene Produktion von ROS bezieht sich auf die Bildung reaktiver Sauerstoffspezies aufgrund des Einflusses von externen Mitteln wie Schadstoffen, Schwermetallen, Rauch, Medikamenten usw.
Was ist der Unterschied zwischen freien Radikalen und reaktiven Sauerstoffspezies?
Wir verwenden normalerweise die Begriffe freie Radikale und reaktive Sauerstoffspezies austauschbar, da reaktive Sauerstoffspezies immer freie Radikalverbindungen sind. Allerdings sind nicht alle freien Radikale reaktive Sauerstoffspezies. Der Hauptunterschied zwischen freien Radikalen und reaktiv.
Nachfolgend finden Sie eine Zusammenfassung des Unterschieds zwischen freien Radikalen und reaktiven Sauerstoffspezies.

Zusammenfassung -freie Radikale gegen reaktive Sauerstoffspezies
Freie Radikale sind reaktive Atome oder eine Gruppe von Atomen, die ein oder mehrere ungepaarte Elektronen enthalten, während reaktive Sauerstoffspezies Radikale sind, die hochreaktiv sind und ungepaarte Elektronen enthalten. Der Hauptunterschied zwischen freien Radikalen und reaktiv.
Referenz:
1.„Reaktive Sauerstoffspezies.Wikipedia, Wikimedia Foundation, 4. November. 2019, hier erhältlich.
2. „Was sind freie Radikale?Phytochemikalien, hier erhältlich.
3. „Radikal (Chemie).Wikipedia, Wikimedia Foundation, 27. November. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Hydroxylradikal" von Smokeyjoe - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Freie Radikalität" von Dan Cojocari - eigener Arbeiter (CC BY -SA 4.0) über Commons Wikimedia


