Unterschied zwischen galvanischer Zelle und Konzentrationszelle
Der Schlüsselunterschied zwischen galvanischer Zelle und Konzentrationszelle ist das a Galvanische Zelle kann die beiden Halbzellen mit der gleichen Zusammensetzung aufweisen oder nicht, während eine Konzentrationszelle zwei halbe Zellen mit derselben Zusammensetzung hat.
Sowohl die galvanische Zelle als auch die Konzentrationszelle sind elektrochemische Zellen. Eine elektrochemische Zelle ist ein Gerät, das mit einer chemischen Reaktion Elektrizität erzeugen kann oder eine chemische Reaktion unter Verwendung von Elektrizität auftritt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist galvanische Zelle
3. Was ist Konzentrationszelle
4. Seite für Seitenvergleich - Galvanische Zelle gegen Konzentrationszelle in tabellarischer Form
5. Zusammenfassung
Was ist eine galvanische Zelle?
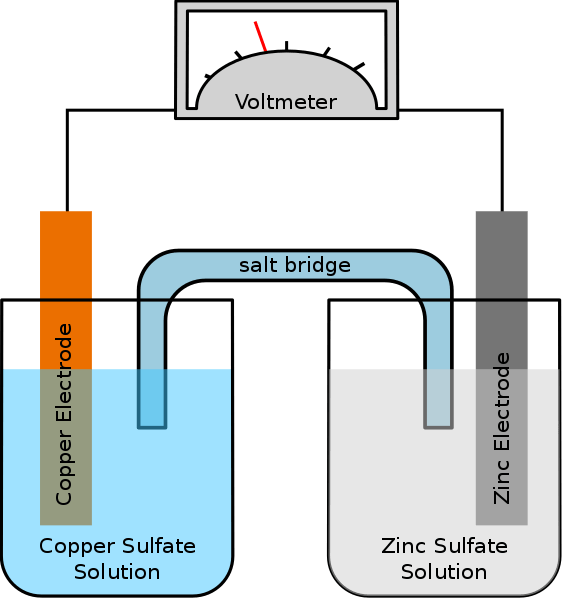
Eine galvanische Zelle ist eine Art elektrochemischer Zelle, die spontane Redoxreaktionen verwendet, um elektrische Energie zu erzeugen. Ein Synonym für diese Zelle ist Voltaic Cell. Die Zelle enthält zwei Halbzellen, die eine derselben Zusammensetzung oder verschiedene Zusammensetzungen haben können. Jede Halbzelle enthält eine Elektrode und einen Elektrolyten. Die Elektrode sollte in die elektrolytische Lösung eingetaucht sein. Manchmal sind diese Elektrolyte vollständig getrennt, aber manchmal werden sie nur durch eine poröse Barriere getrennt. Wenn die Elektrolyte vollständig getrennt sind, müssen wir eine Salzbrücke verwenden, um die Bewegung von Ionen zwischen den beiden Elektrolyten aufrechtzuerhalten.

Abbildung 01: einfache galvanische Zelle
Bei der Vorbereitung dieser Zelle müssen wir überlegen, ob die Elektroden und Elektrolyte spontan sind oder nicht. Wir können es theoretisch finden, indem wir die Elektrodenpotentiale jeder halben Zelle berechnen. Die halbe Zelle sollte jedoch eine Oxidation zeigen, während die andere halbe Zelle eine Reduktionsreaktion aufweisen sollte. Oxidation tritt bei der Anode auf, während bei der Kathode eine Reduktion auftritt. Da eine galvanische (voltaische) Zelle die Energie verwendet, die während einer spontanen Redoxreaktion freigesetzt wird, um Elektrizität zu erzeugen. Sie erzeugen direkten Strom.
Was ist eine Konzentrationszelle?
Die Konzentrationszelle ist eine Art galvanische Zelle, in der die beiden Halbzellen der Zelle in der Zusammensetzung ähnlich sind. Daher sagen wir, die beiden Halbzellen sind gleichwertig. Sie unterscheiden sich nur in der Konzentration. Die von dieser Zelle erzeugte Spannung ist sehr gering, da diese Zelle dazu neigt, einen Gleichgewichtszustand zu erhalten. Das Gleichgewicht kommt, wenn die Konzentrationen der beiden Halbzellen gleich werden.
Die Konzentrationszelle erzeugt Elektrizität durch Verringerung der thermodynamischen freien Energie des Systems. Da die Zusammensetzung der Halbzellen ähnlich ist, tritt die gleiche Reaktion auf, jedoch in entgegengesetzte Richtungen. Dieser Prozess erhöht die Konzentration der niedrigeren Konzentrationszelle und verringert die Konzentration der höheren Konzentrationszelle. Wenn der Strom fließt, wird thermische Energie erzeugt. Die Zelle absorbiert diese Energie als Wärme. Es gibt zwei Arten von Konzentrationszellen wie folgt:
- Elektrolytkonzentrationszelle - Die Elektroden bestehen aus derselben Substanz, und die Halbzellen enthalten den gleichen Elektrolyten mit unterschiedlichen Konzentrationen
- Elektrodenkonzentrationszelle - Zwei Elektroden (derselben Substanz) unterschiedlicher Konzentrationen werden in denselben Elektrolyten getaucht
Was ist der Unterschied zwischen galvanischer Zelle und Konzentrationszelle?
Eine galvanische Zelle ist eine Art elektrochemischer Zelle, die spontane Redoxreaktionen verwendet, um elektrische Energie zu erzeugen. Eine Konzentrationszelle hingegen ist eine Art galvanische Zelle, in der die beiden Halbzellen der Zelle in der Zusammensetzung ähnlich sind. Daher besteht der Hauptunterschied zwischen galvanischer Zelle und Konzentrationszelle darin, dass galvanische Zellen die beiden Halbzellen mit derselben Zusammensetzung aufweisen können oder nicht, während die Konzentrationszelle zwei halbe Zellen mit derselben Zusammensetzung aufweist.
Darüber hinaus können die Elektroden der galvanischen Zelle entweder aus derselben Substanz oder unterschiedlichen Substanzen bestehen, während die Elektroden der Konzentrationszelle aus derselben Substanz mit derselben Konzentration oder unterschiedlichen Konzentrationen bestehen. Zusätzlich zu diesen haben galvanische Zellen den gleichen Elektrolyten oder unterschiedlichen Elektrolyten in zwei Halbzellen, während Konzentrationszellen den gleichen Elektrolyten mit derselben Konzentration oder unterschiedlichen Konzentrationen aufweisen.
Die folgende Infografik fasst den Unterschied zwischen galvanischer Zelle und Konzentrationszelle zusammen.

Zusammenfassung -Galvanische Zelle gegen Konzentrationszelle
Eine galvanische Zelle ist eine Art elektrochemischer Zelle, die spontane Redoxreaktionen verwendet, um elektrische Energie zu erzeugen. Die Konzentrationszelle ist eine Art galvanische Zelle, in der die beiden Halbzellen der Zelle in der Zusammensetzung ähnlich sind. Daher besteht der Hauptunterschied zwischen galvanischer Zelle und Konzentrationszelle darin, dass galvanische Zellen die beiden Halbzellen mit derselben Zusammensetzung aufweisen können oder nicht, während die Konzentrationszelle zwei halbe Zellen mit derselben Zusammensetzung aufweist.
Referenz:
1. Helmenstine, Anne Marie. „Elektrochemische Zellen.”Thoughtco, Jan. 26, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Galvanische Zelle" von Gringer - Datei: Galvanische Zelle.PNG nach Tinux (CC BY-SA 3.0) über Commons Wikimedia


