Unterschied zwischen Gram -Atommasse und Grammolekularmasse
Der Schlüsselunterschied Zwischen gramatomarer Masse und Grammolekularmasse befindet sich die Gram -Atommasse gibt die Masse eines einzelnen Atom.
Atommasse und molekulare Masse (oder Molmasse) sind in Bezug auf Atome und Moleküle sehr wichtig. Wenn wir diese Werte in Grammeinheiten ausdrücken, dann handelt es sich um Gram -Atom-/Molekülmasse.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Gram Atommasse
3. Was ist Grammolekularmasse
4. Seite an Seitenvergleich - Gram Atommasse gegen Grammolekülmasse in tabellarischer Form
5. Zusammenfassung
Was ist Gram Atommasse?
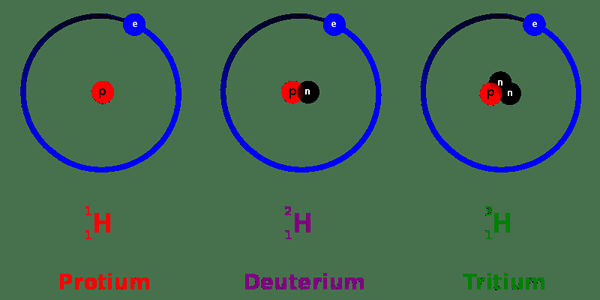
Die Gram -Atommasse ist die Atommasse, die mit der Einheit „Gramm“ ausgedrückt wird. Der Wert dieses Parameters entspricht numerisch der Atommasse, die durch die Einheit „U“ angegeben ist. Dieser Begriff ist sehr eng mit der Massenzahl verwandt. Es bedeutet tatsächlich das Gleiche wörtlich; In diesem Fall werden jedoch auch die isotopischen Formen jedes Elements gezählt. Elemente können in verschiedenen Formen in der Natur existieren. Diese verschiedenen Formen sind allgemein als Isotope bekannt und haben die gleiche Identität wie die am häufigsten vorkommende/stabile Form des Elements. Daher haben Isotope die gleiche Atomzahl, aber sie haben unterschiedliche Massenzahlen. Es kann geschlossen werden, dass Isotope die gleiche Menge an Protonen und Elektronen tragen; Es ist nur die Anzahl der Neutronen, die sich unterscheiden. Was sich zwischen ihnen unterscheidet, ist daher das Gewicht.

Abbildung 01: Wasserstoffisotope
Wenn jede isotopische Form berücksichtigt wird. Dies wird auch als "Atommasse" eines Elements bezeichnet. Daher hat die Atommasse fast den gleichen numerischen Wert wie die Massenzahl, mit nur einer Änderung einiger Dezimalwerte. Jede Zahl wird je nach Nutzungskontext für die Zwecke der Bequemlichkeit verwendet.
Was ist Grammolekularmasse?
Die Grammolekülmasse eines Moleküls ist die Masse eines Moles dieses Moleküls aus der Einheit „Gramm“. Das bedeutet; Es ist die Summe der Massen von Molekülen, die in einem Maulwurf vorhanden sind. Es wird unter Verwendung der molekularen Formel eines Moleküls berechnet. Hier werden die Atomgewichte jedes Atoms in G/Mol -Einheit hinzugefügt, um die molekulare Masse zu erhalten.
Ein Mol eines Moleküls besteht aus 6.023 x 1023 Moleküle. Daher ist die molekulare Masse das Gewicht von 6.023 x 1023 Moleküle. Da die Atommassen jedes Elements bekannt sind, ist es leicht, die molekulare Masse zu berechnen, anstatt an eine 6 zu denken.023 x 1023 von Molekülen.
Was ist der Unterschied zwischen Gram -Atommasse und Grammolekularmasse?
Gram -Atommasse und Grammolekularmasse sind die gleichen wie Atommasse und Molekülmasse, die in der Einheit „Gramm“ exprimiert werden. Daher besteht der Hauptunterschied zwischen Gram -Atommasse und Grammolekularmasse darin, dass die Gram -Atommasse die Masse eines einzelnen Atoms ergibt.
Die folgende Infografik fasst den Unterschied zwischen Gram -Atommasse und Grammolekularmasse zusammen.
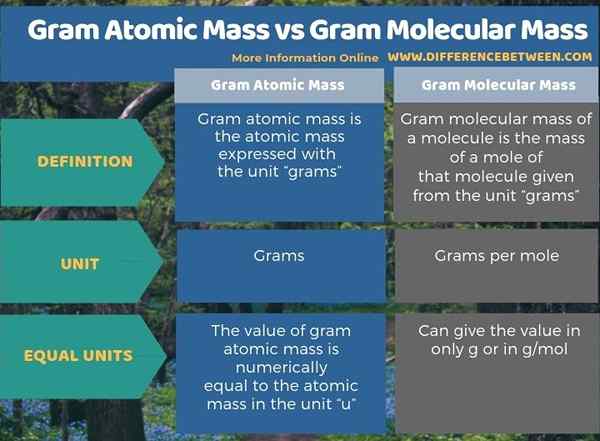
Zusammenfassung -Gram -Atommasse gegen Grammolekularmasse
Gram -Atommasse und Grammolekularmasse sind die gleichen wie Atommasse und Molekülmasse, die in der Einheit „Gramm“ exprimiert werden. Daher besteht der Hauptunterschied zwischen Gram -Atommasse und Grammolekularmasse darin, dass die Gram -Atommasse die Masse eines einzelnen Atoms ergibt.
Referenz:
1. Helmenstine, Anne Marie. „Grammolekularmassendefinition.”Thoughtco, Jul. 3, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Wasserstoff Deuterium Tritium nuclei matic -en" von Dirk Hünniger; Derivatarbeit in englischer Sprache - Balajijagadesh - Diese Datei wurde abgeleitet aus: Wasserstoff Deuterium tritium nuclei maticat -de.SVG (CC BY-SA 3.0) über Commons Wikimedia


