Unterschied zwischen Halogenen und Halogeniden

Der Schlüsselunterschied Zwischen Halogenen und Halogeniden ist das die Halogene sind chemische Elemente mit einem ungepaarten Elektron in ihrem äußersten P -Orbital, während die Halogenide keine ungepaarten Elektronen haben.
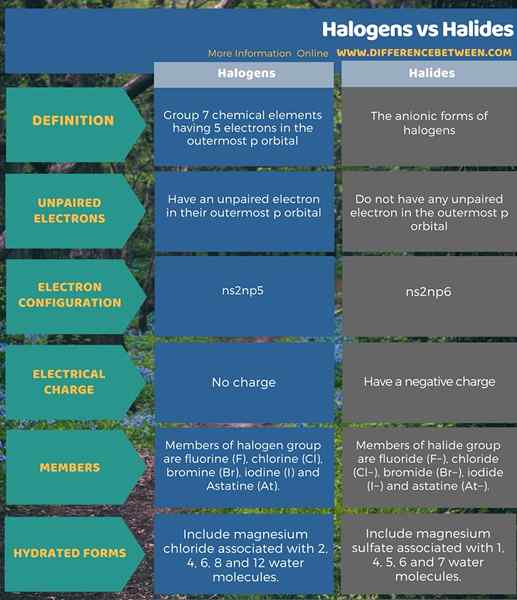
Halogene sind die Elemente der Gruppe 7. Da sie ein ungepaartes Elektron in den P -Orbitalen haben, beträgt der häufigste Oxidationszustand von Halogenen -1, weil sie stabil werden können, indem sie ein Elektron erhalten. Dieses Elektronengewinn bildet ein Halogenid. Daher sind Halogenide die anionische Form von Halogenen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Halogene
3. Was sind Halogenide
4. Seite an Seite Vergleich - Halogens gegen Halogenide in tabellarischer Form
5. Zusammenfassung
Was sind Halogene?
Halogene sind chemische Elemente der Gruppe 7 mit 5 Elektronen im äußersten P -Orbital mit. Darüber hinaus haben diese Elemente ein ungepaartes Elektron in ihrem äußersten P -Orbital. Daher ist es sehr reaktiv, ein Elektron von außen zu erhalten und stabil zu werden. Sie bilden leicht die anionische Form, Halogenid, indem sie ein Elektron erhalten.

Abbildung 01: Aussehen von Halogenen. (Von links nach rechts: Chlor, Brom, Jod.)
Die Mitglieder dieser Gruppe sind Fluor (F), Chlor (CL), Brom (Br), Jod (I) und Astatin (AT). Darüber hinaus ist der Grund, ihnen den Namen Halogen zu geben, dass sie alle Natriumsalze mit ähnlichen Eigenschaften bilden können. Wir können alle Phasen der Materie in dieser Gruppe sehen; Fluor und Chlor sind Gase in der Natur, Brom ist eine Flüssigkeit und Jod ist eine feste Verbindung unter normalen Bedingungen. Astatine ist ein radioaktives Element. Darüber hinaus ist die allgemeine Elektronenkonfiguration dieser Elemente NS2np5.
Was sind Halogenide?
Halogenide sind die anionischen Formen von Halogenen. Daher bildet sich diese chemischen Spezies, wenn ein Halogen ein Elektron von außen erhält, um eine stabile Elektronenkonfiguration zu erhalten. Dann wird die Elektronenkonfiguration zu NS2np6. Ein Halogenid hat jedoch immer eine negative Ladung. Die Mitglieder dieser Gruppe umfassen Fluorid (F. F-), Chlorid (Cl-), Bromid (Br-), Jodid (ich-) und Astatine (bei-). Die Salze mit diesen Ionen sind halide Salze. Darüber hinaus sind alle diese Halogenide farblos und treten in festen kristallinen Verbindungen auf. Diese Feststoffe haben eine hohe negative Enthalpie der Bildung. Daher bedeutet dies, dass diese Feststoffe leicht gebildet werden.
Es gibt spezifische Tests, aus denen wir das Vorhandensein eines Halogenids identifizieren können. Zum Beispiel können wir Silbernitrat verwenden, um das Vorhandensein von Chloriden, Bromiden und Iodden anzuzeigen. Das liegt daran. Wenn wir Silbernitrat zu einer Lösung der Bromid enthalten, bildet sich ein cremiger Silberbromid -Niederschlag. Für Iodidionen, die Lösungen enthalten, gibt es einen grün gefärbten Niederschlag. Wir können jedoch kein Fluorid aus diesem Test identifizieren, da Fluoride keine Ausfälle mit Silbernitrat bilden können.
Was ist der Unterschied zwischen Halogenen und Halogeniden?
Halogene sind die chemischen Elemente der Gruppe 7 mit 5 Elektronen im äußersten P -Orbital, einschließlich eines ungepaarten Elektrons. Halogenide sind die anionischen Formen von Halogenen und haben kein ungepaartes Elektron. Dies ist der Hauptunterschied zwischen Halogenen und Halogeniden. Darüber hinaus sind die Mitglieder der Halogengruppe Fluor (F), Chlor (CL), Brom (BR), Jod (I) und Astatine (AT). Andererseits sind die Mitglieder der Halide Group Fluorid (F. F-), Chlorid (Cl-), Bromid (Br-), Jodid (ich-) und Astatine (bei-). Nachfolgend ist der detaillierte Unterschied zwischen Halogenen und Halogeniden in tabellarischer Form aufgeführt.
Zusammenfassung -halogene gegen Halogenide
Halogene sind Elemente der Gruppe 7 mit einem ungepaarten Elektron am äußeren Orbital mit. Sie bilden sich in Halogenide, indem sie ein Elektron gewinnen und stabil werden. Daher besteht der Hauptunterschied zwischen Halogenen und Halogeniden darin, dass die Halogene chemische Elemente mit einem ungepaarten Elektron in ihrem äußersten P -Orbital sind, während die Halogenide keine ungepaarten Elektronen haben.
Referenz:
1. „Halogenid.Wikipedia, Wikimedia Foundation, 27. Juni 2018. Hier verfügbar
2. Christen, Karl et al. „Halogenelement.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3. November. 2017. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Halogens'By W. Oelen - Wissenschaft lebend gemacht: Chemie, (CC BY -SA 3.0) über Commons Wikimedia


