Unterschied zwischen Wärmekapazität und spezifischer Wärme
Der Schlüsselunterschied Zwischen Wärmekapazität und spezifischer Wärme ist das Die Wärmekapazität hängt von der Substanzmenge ab, während die spezifische Wärmekapazität unabhängig davon ist.
Wenn wir eine Substanz erhitzen, steigt die Temperatur und wenn wir sie abkühlen, nimmt die Temperatur ab. Dieser Temperaturunterschied ist proportional zur gelieferten Wärmemenge. Wärmekapazität und spezifische Wärme sind zwei Verhältnismäßigkeitskonstanten, die sich auf die Temperaturänderung und die Wärmemenge beziehen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Wärmekapazität
3. Was ist bestimmte Wärme
4. Seite an Seite Vergleich - Wärmekapazität gegenüber spezifischen Wärme in tabellarischer Form
5. Zusammenfassung
Was ist Wärmekapazität?
In der Thermodynamik ist die Gesamtenergie eines Systems die interne Energie. Interne Energie legt die gesamte kinetische und potentielle Energie von Molekülen im System fest. Wir können die interne Energie eines Systems entweder durch Arbeit am System oder durch Erhitzen ändern. Die innere Energie einer Substanz nimmt zu, wenn wir seine Temperatur erhöhen. Die Höhe der Erhöhung hängt von den Bedingungen ab, unter denen eine Heizung stattfindet. Hier brauchen wir Wärme, um die Temperatur zu erhöhen.
Wärmekapazität (c) einer Substanz ist „die Wärmemenge, die zur Erhöhung der Temperatur eines Substanzs um einen Grad Celsius (oder einen Kelvin) erforderlich ist.Die Wärmekapazität unterscheidet sich von Substanz zu Substanz. Die Substanzmenge ist direkt proportional zur Wärmekapazität. Das heißt, durch Verdoppelung der Masse einer Substanz wird die Wärmekapazität verdoppelt. Die Wärme, die wir benötigen, um die Temperatur von t zu erhöhen1 zu t2 einer Substanz kann unter Verwendung der folgenden Gleichung berechnet werden.
q = c x ∆t
q = Erforderliche Hitze
∆t = t1-T2

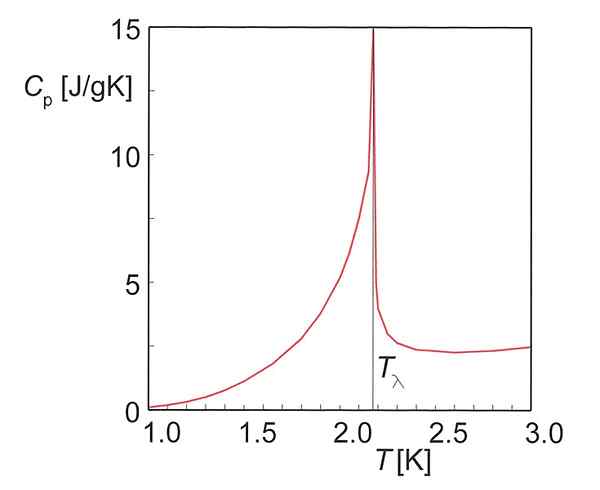
Abbildung 01: Wärmekapazität von Helium
Die Wärmekapazitätseinheit ist JºC-1 oder jk-1. Zwei Arten von Wärmekapazitäten werden in der Thermodynamik definiert; Wärmekapazität bei konstantem Druck und Wärmekapazität bei konstantem Volumen.
Was ist bestimmte Wärme?
Wärmekapazität hängt von der Substanzmenge ab. Spezifische Wärme oder spezifische Wärmekapazität (en) ist die Wärmekapazität, die unabhängig von der Menge an Substanzen ist. Wir können es als „die Wärmemenge definieren.”
Die Einheit spezifischer Wärme ist JG-1oC-1. Die spezifische Wasserwärme ist sehr hoch, mit einem Wert von 4.186 Jg-1oC-1. Dies bedeutet, dass wir die Temperatur von 1 g Wasser um 1 ° C erhöhen können, wir brauchen 4.186 j Wärmeenergie. Dieser hohe Wert macht die Rolle von Wasser in der thermischen Regulierung aus. Um die Wärme zu finden, die erforderlich ist, um die Temperatur einer bestimmten Masse einer Substanz von T1 nach T2 zu erhöhen, kann die folgende Gleichung verwendet werden.
q = m x s x ∆t
q = Erforderliche Hitze
M = Masse der Substanz
∆t = t1-T2
Die obige Gleichung gilt jedoch nicht, wenn die Reaktion eine Phasenänderung beinhaltet. Zum Beispiel, wenn Wasser in eine Gasphase (am Siedepunkt) oder wenn Wasser zum Eis erfriert (am Schmelzpunkt), wenn Wasser gefriert, um Eis zu bilden (am Schmelzpunkt). Dies liegt daran.
Was ist der Unterschied zwischen Wärmekapazität und spezifischer Wärme?
Der Schlüsselunterschied zwischen Wärmekapazität und spezifischer Wärme besteht darin. Bei Betrachtung der Theorie ist die Wärmekapazität der Wärmemenge, die zur Änderung der Temperatur einer Substanzen erforderlich ist, um 1 ° C oder 1k, während spezifische Wärme die Wärme ist.

Zusammenfassung -Wärmekapazität gegen spezifische Wärme
Wärmekapazität und spezifische Wärme sind wichtige Begriffe in der Thermodynamik. Der Schlüsselunterschied zwischen Wärmekapazität und spezifischer Wärme besteht darin.
Referenz:
1. Helmenstine, Anne Marie. „Spezifische Wärmekapazität in der Chemie.”Thoughtco, Mar. 21, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Wärmekapazität von 4he 01" von Adwaele bei English Wikipedia (CC BY-SA 3.0) über Commons Wikimedia


