Unterschied zwischen Hybridisierung und Überlappung
Der Schlüsselunterschied Zwischen Hybridisierung und Überlappung ist das Hybridisierung bezieht sich auf die Bildung neuer hybridorbitale durch Überlappung von Atomorbitalen.
Orbitale sind hypothetische Strukturen, die mit Elektronen gefüllt werden können. Nach verschiedenen Entdeckungen schlugen Wissenschaftler verschiedene Formen für diese Orbitale vor. Es gibt drei Hauptorbitale: Atomorbitale, molekulare Orbitale und Hybridorbitale. Hybridorbitale bilden sich über den Prozess der Hybridisierung. Hybridisierung und Überlappung sind zwei verwandte chemische Konzepte. Die Überlappung von Atomorbitalen tritt während der Hybridisierung auf.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Hybridisierung
3. Was ist überlappend
4. Seite für Seitenvergleich - Hybridisierung vs. überlappend in tabellarischer Form
5. Zusammenfassung
Was ist Hybridisierung?
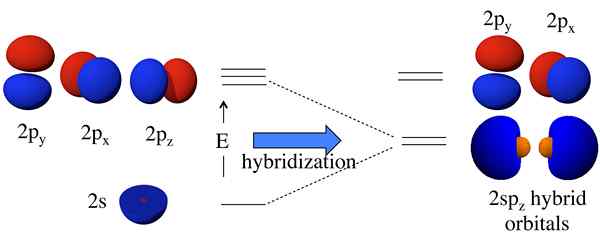
Hybridisierung ist ein chemischer Prozess, bei dem sich Hybridorbitale aus der Mischung von Atomorbitalen bilden. Die Hybridisierungstheorie ist eine Technik, mit der wir die Orbitalstruktur eines Moleküls beschreiben. Grundsätzlich ist Hybridisierung die Bildung von Hybridorbitalen durch Mischen von zwei oder mehr atomaren Orbitalen. Die Ausrichtung dieser Orbitale bestimmt die Geometrie des Moleküls. Es ist eine Expansion der Valenz -Bond -Theorie.
Vor der Bildung der atomaren Orbitale haben sie unterschiedliche Energien, aber nach der Bildung haben alle Orbitale die gleiche Energie. Zum Beispiel kann ein S -Atom -Orbital und ein P -Atom -Orbital zu zwei SP -Orbitalen bilden. Die S- und P -Atomorbitale haben unterschiedliche Energien (Energie von s < energy of p). But, after hybridization, it forms two sp orbitals which have the same energy, and this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

Abbildung 01: Bildung von Hybridorbitalen
Die Idee der Hybridisierung kam zuerst in die Diskussion, da die Valenzbindungstheorie die Struktur einiger Moleküle wie CH nicht korrekt vorhergesagt hat4. Obwohl das Kohlenstoffatom in CH4 hat nur zwei ungepaarte Elektronen gemäß seiner Elektronenkonfiguration, es kann vier kovalente Bindungen bilden. Um vier Bindungen zu bilden, müssen vier ungepaarte Elektronen vorhanden sein.
Die einzige Möglichkeit, dieses Phänomen zu erklären. Hier gibt ein S + drei p 4 sp3 Orbitale. Daher füllen die Elektronen diese hybriden Orbitale gleichmäßig (ein Elektron pro hybridem Orbital) und folgen der Hunder -Regel. Somit gibt es vier Elektronen zur Bildung von vier kovalenten Bindungen mit vier Wasserstoffatomen.
Was ist überlappend?
Überlappung ist der chemische Prozess, bei dem sich Atomorbitale miteinander überlappen. Mit anderen Worten, es ist die Konzentration von Orbitalen im Raum zwischen verschiedenen Atomen, was zur Bildung chemischer Bindungen führt. Linus Pauling entwickelte zuerst die Theorie zu diesem Orbitallupen. Er erklärte die molekularen Bindungswinkel in verschiedenen Molekülen, und dieses Konzept war die Grundlage für die Hybridisierungstheorie.
Was ist der Unterschied zwischen Hybridisierung und Überlappung?
Hybridisierung und Überlappung sind zwei verwandte chemische Konzepte. Der Hauptunterschied zwischen Hybridisierung und Überlappung besteht darin, dass die Hybridisierung die Bildung neuer Hybridorbitale durch Überlappung von Atomorbitalen bildet, während sich überlappend das Mischen von Atomorbitalen ist. Darüber hinaus überlappen sich Orbitale derselben Atome im Hybridisierungsprozess, um sich im Überlappungsprozess hybride Orbitale zu bilden.
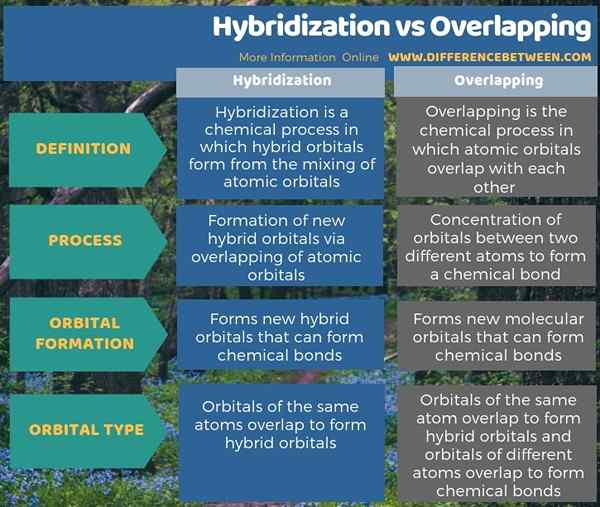
Die folgende Infografik zeigt mehr Fakten zum Unterschied zwischen Hybridisierung und Überlappung.
Zusammenfassung -Hybridisierung gegen Überlappung
Hybridisierung und Überlappung sind zwei verwandte chemische Konzepte. Zusammenfassend lässt sich sagen, dass der Hauptunterschied zwischen Hybridisierung und Überlappung besteht.
Referenz:
1. Helmenstine, Anne Marie. „Hybrid Orbital Definition.”Thoughtco, Jun. 22, 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "SP Hybridisierung" von TEM5PSU - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


