Unterschied zwischen idealem Gasrecht und realem Gasrecht
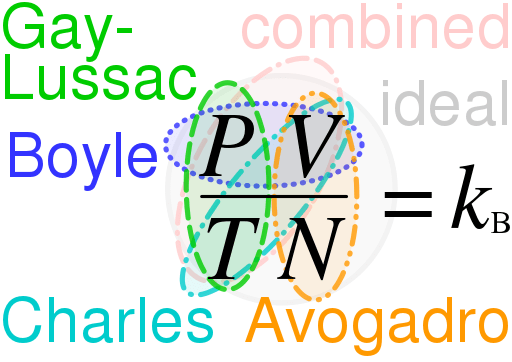
Der Schlüsselunterschied Zwischen dem idealen Gasrecht und dem realen Gasrecht ist das Das ideale Gasgesetz beschreibt das Verhalten eines theoretischen Gases, während das reale Gasgesetz das Verhalten von tatsächlich auftretenden Gasen im Universum beschreibt.
Ein ideales Gas ist ein theoretisches Gas, dessen sich zufällig bewegende Gaspartikel vollständig elastische Kollisionen und keine anderen Wechselwirkungen zwischen ihnen haben. Nach dieser Definition können wir verstehen, dass diese idealen Gase nicht in der Natur auftreten können, da es im Wesentlichen Wechselwirkungen zwischen Gaspartikeln für jedes Gas gibt, das wir kennen. Tatsächlich sind die Gase, die wir kennen, echte Gase.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ideales Gasgesetz
3. Was ist das echte Gasgesetz
4. Seite an Seite Vergleich - Ideales Gasrecht gegen das echte Gasrecht in tabellarischer Form
5. Zusammenfassung
Was ist das ideale Gasgesetz?
Ideales Gasrecht ist eine Gleichung, die das Verhalten eines idealen Gases beschreibt. Ideale Gase sind hypothetisch, und diese Gase treten nur in Theorien auf. Wenn wir das ideale Gasgesetz verwenden, können wir das Verhalten vieler realer Gase, die wir kennen, verstehen und abschätzen. Es hat jedoch mehrere Einschränkungen. Außerdem ist dieses Gesetz eine Kombination mehrerer anderer Gesetze:
- Boyles Gesetz
- Charles 'Gesetz
- Avogadros Gesetz
- Gay-Lussacs Gesetz
Berechnung
Grundsätzlich können wir das ideale Gasgesetz wie folgt geben
Pv = nrt
Wo ist P Druck, V ist Volumen und T die Temperatur des idealen Gass ist. Hier ist „N“ die Anzahl der Maulwürfe des idealen Gas und „R“ eine Konstante - wir nennen es es Ideales Gaskonstant. Es hat einen universellen Wert; Der Wert von R ist für jedes Gas gleich und es ist 8.314 j/(k · mol).
Darüber hinaus können wir verschiedene Derivate aus diesem Gesetz erhalten; molare Form, kombinierte Form usw. Da „N“ beispielsweise die Anzahl der Maulwürfe ist, können wir sie unter Verwendung des Molekulargewichts des Gases geben. Die Ableitung lautet wie folgt.
n = m/m
Wo, n ist die Anzahl der Gasmolen, M ist die Masse des Gases und M das Molekulargewicht des Gases. Durch Verwendung der obigen Gleichung,
Pv = nrt
Pv = (m/m) rt
Wenn wir die Dichte des Gases bekommen wollen, können wir die obige Gleichung wie folgt verwenden
P = (m/vm) rt
P = ρrt/m
Wenn wir das kombinierte Gasgesetz aus dem idealen Gasgesetz erhalten möchten, können wir es außerdem wie folgt ableiten. Für zwei Gase „1“ und „2“ sind Druck, Volumen und Temperatur p p1,V1,T1 und P2, V2 und T2. Dann können wir für die beiden Gase zwei Gleichungen schreiben wie;
P1V1 = Nrt1… (1)
P2V2 = Nrt2 … (2)
Durch die Aufteilung der Gleichung (1) aus Gleichung (2) bekommen wir,
(P1V1)/(P2V2) = T1/ T2
Wir können diese Gleichung wie folgt neu ordnen
P1V1/ T1 = P2V2/ T2
Was ist das echte Gasgesetz?
Reales Gasgesetz, auch genannt Van der Waals Gesetz, wird aus dem idealen Gasgesetz abgeleitet, um das Verhalten von echten Gasen zu beschreiben. Da reale Gase sich nicht im Idealfall nicht verhalten können, hat das reale Gasgesetz Änderungen der Druck- und Volumenkomponenten im idealen Gasgesetz vorgenommen. Somit können wir das Volumen und den Druck wie folgt erhalten:
Volumen von echtem Gas = (vM - B)
Druck von realem Gas = (p + a n2/V2)
Anschließend können wir das reale Gasgesetz erhalten, indem wir diese geänderten Komponenten wie folgt auf das ideale Gasgesetz anwenden:
(P + a n2/V2) (VM - b) = nrt
Wo, vM ist das molare Gasvolumen, R ist eine universelle Gaskonstante, t ist die Temperatur von realem Gas, P ist der Druck.
Was ist der Unterschied zwischen dem idealen Gasrecht und dem realen Gasrecht?
Ideales Gasrecht ist eine Gleichung, die das Verhalten eines idealen Gases beschreibt. Das echte Gasrecht wird aus dem idealen Gasgesetz abgeleitet, um das Verhalten von echten Gasen zu entsprechen. Der zentrale Unterschied zwischen dem idealen Gasrecht und dem realen Gasrecht besteht also darin, dass das ideale Gasgesetz das Verhalten eines theoretischen Gases beschreibt, während das reale Gasgesetz das Verhalten von tatsächlich vorkommenden Gasen im Universum beschreibt.
Darüber hinaus können wir das ideale Gasgesetz aus der Gleichung PV = NRT und das reale Gasgesetz aus der Gleichung (p + a n2/V2) (VM - b) = nrt.
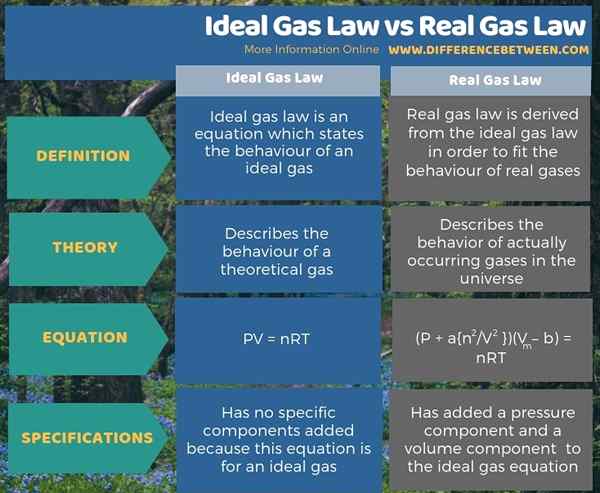
Zusammenfassung -ideales Gasrecht gegen das echte Gasrecht
Kurzer. Der Hauptunterschied zwischen dem idealen Gasrecht und dem realen Gasrecht besteht darin, dass das ideale Gasrecht das Verhalten eines theoretischen Gases beschreibt, während das reale Gasgesetz das Verhalten von tatsächlich auftretenden Gasen im Universum beschreibt.
Referenz:
1. Ideales Gasrecht, Hyperphysik. Georgia State University, hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Ideal Gas Law Beziehungen" von Cmglee - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. „Ideales Gasrecht“ von Blyumj - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


