Unterschied zwischen intramolekularer Redox und unverhältnismäßiger Redoxreaktion
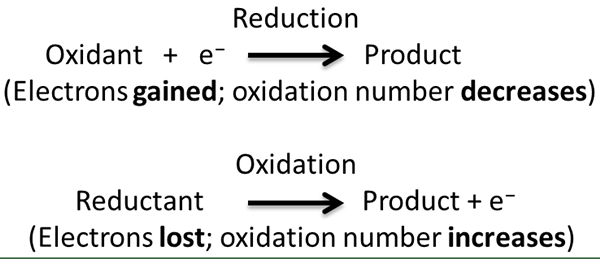
Der Schlüsselunterschied zwischen intramolekularer Redox und unverhältnismäßiger Redoxreaktion ist das Intramolekulare Redoxreaktionen treten auf, wenn ein einzelnes Molekül im gleichen chemischen Element oder unterschiedlichen chemischen Elementen oxidiert und reduziert wird.
Intramolekulare Redoxreaktionen und unverhältnismäßige Redoxreaktionen sind zwei Arten von anorganischen chemischen Reaktionen, bei denen Oxidations- und Reduktionsreaktionen parallel zueinander auftreten. Beide chemischen Reaktionen beinhalten die Oxidation und Reduktion halber Reaktionen, die in derselben chemischen Verbindung/ in einem einzelnen Substratmolekül auftreten. Die beiden Typen unterscheiden sich je nach dem chemischen Element, in dem diese Halbreaktionen stattfinden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind intramolekulare Redoxreaktionen
3. Was sind überproportionale Redoxreaktionen
4. Seite für Seitenvergleich - intramolekulares Redox gegenüber einer unverhältnismäßigen Redoxreaktion in tabellarischer Form
5. Zusammenfassung
Was sind intramolekulare Redoxreaktionen?
Intramolekulare Redoxreaktionen sind chemische Reaktionen, die ein einzelnes Substrat beinhalten, bei dem Oxidation und Reduktion im selben chemischen Element oder in zwei verschiedenen chemischen Elementen auftreten. Mit anderen Worten, in einigen intramolekularen Redoxreaktionen treten Oxidation und Reduktion in demselben chemischen Element auf, während in anderen intramolekularen Redoxreaktionen die Oxidation und Reduktion in zwei verschiedenen chemischen Elementen auftreten. Wenn die Oxidation und Verringerung im selben chemischen Element auftritt, nennen wir sie als unverhältnismäßig.

Abbildung 01: Chemischer Prozess einer Redoxreaktion
Was sind überproportionale Redoxreaktionen?
Überproportionale Redoxreaktionen sind chemische Reaktionen, bei denen Oxidation und Reduktion im selben chemischen Element eines einzelnen Substratmoleküls auftreten. In dieser Art von Reaktionen funktioniert ein einzelnes Substratmolekül in beide Richtungen, wodurch die Halbreaktionen oxidiert und reduziert werden. Hier wird ein Teil des Moleküls einer Oxidation erfährt, während der andere Teil des Moleküls eine Reduktion unterliegt. Beide molekularen Teile beinhalten jedoch das gleiche chemische Element, bei dem Oxidation oder Reduktion auftritt. Ein Beispiel ist wie folgt:
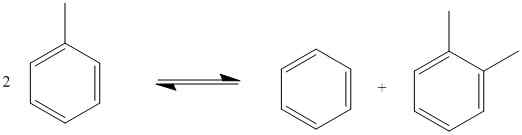
Abbildung 02: Ein Beispiel für eine unverhältnismäßige Redoxreaktion
Ein weiteres häufiges Beispiel für diese Art von chemischen Reaktionen ist die Überproportionierung des Sauerstoffatoms im Wasserstoffperoxid H2O2 -Molekül. Hier wird der Sauerstoff in Wasserstoffperoxidmolekül oxidiert, um Sauerstoffgas zu bilden, und das gleiche Molekül erfährt eine Reduktion, um ein Wassermolekül zu bilden.
Was ist der Unterschied zwischen intramolekularer Redox und unverhältnismäßiger Redoxreaktion?
Redoxreaktionen sind chemische Reaktionen, bei denen eine Oxidations-Halbreaktion und eine Reduktionshautreaktion parallel zueinander auftreten. Der Schlüsselunterschied zwischen intramolekularer Redox und unverhältnismäßiger Redoxreaktion besteht darin, dass intramolekulare Redoxreaktionen auftreten.
Unproportionierung von c6H2(NEIN2)3CH3 zu bilden n2 Durch Reduktion und C über Oxidation ist ein Beispiel für eine intramolekulare Redoxreaktion, während die Unverhältnis des Sauerstoffatoms in einem Wasserstoffperoxidmolekül ein Beispiel für eine unverhältnismäßige Redoxreaktion ist.
Die folgende Infografik fasst die Unterschiede zwischen intramolekularer Redox und unverhältnismäßiger Redoxreaktion in tabellarischer Form für den Nebenseitigen Vergleich zusammen.

Zusammenfassung -intramolekulare Redox gegenüber unverhältnismäßigen Redoxreaktion
Redoxreaktionen sind chemische Reaktionen mit Oxidations- und Reduktionsreaktionen, die parallel zueinander stattfinden. Der Schlüsselunterschied zwischen intramolekularer Redox und unverhältnismäßiger Redoxreaktion besteht darin, dass intramolekulare Redoxreaktionen auftreten.
Referenz:
1. Mott, Vallerie. „Arten von Redoxreaktionen.” Lumen - Einführung in die Chemie, Hier verfügbar.
2. Helmenstine, Anne Marie. „Die Definition von Unverhältnisungen in der Chemie.” Denke, Hier verfügbar.


