Unterschied zwischen elektropositiven und elektronegativen Radikalen
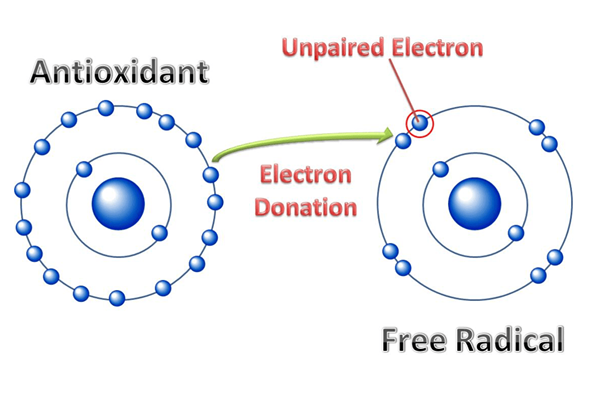
Der Schlüsselunterschied zwischen elektropositiven und elektronegativen Radikalen ist das Elektropositive Radikale sind radikale Verbindungen mit der Fähigkeit, Elektronen zu verlieren und eine positive Ladung zu tragen, während elektronegative Radikale radikale Verbindungen sind, die die Fähigkeit haben, Elektronen zu gewinnen und eine negative Ladung zu tragen.
Ein Radikal in der Chemie ist ein Atom, ein Molekül oder ein Ion, das ein ungepaartes Valenzelektron enthält. In den meisten Fällen macht dieses ungepaarte einzelne Elektron eine chemische Verbindung hochreaktiv. Darüber hinaus wird auch ein Atom, Ionen oder Molekül mit einer offenen Elektronenschale, die Elektronen erhalten kann. Aufgrund der hochreaktiv.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind elektropositive Radikale
3. Was sind elektronegative Radikale
4. Seite für Seite Vergleich - Elektropositive vs. elektronegative Radikale in tabellarischer Form
5. Zusammenfassung
Was sind elektropositive Radikale?
Elektropositive Radikale sind Atome, Ionen oder Moleküle, die ein Elektron verlieren und eine positive elektrische Ladung tragen können. Ein elektropositives Radikal wird aufgrund der elektropositiven Natur einer chemischen Spezies gebildet, was bedeutet, dass eine bestimmte chemische Spezies die Tendenz hat, Elektronen zu verlieren, um positive Radikale zu bilden. Darüber hinaus umfassen einige Beispiele für elektropositive Radikale Kalziumkation (CA)+2), Natriumkation (Na+), usw.

Abbildung 01: Bildung eines Radikals
Was sind elektronegative Radikale?
Elektronegative Radikale sind Atome, Ionen oder Moleküle, die ein Elektron gewinnen und eine negative elektrische Ladung tragen können. Ein elektronegatives Radikal wird aufgrund der hohen Elektronegativität einer chemischen Spezies gebildet, dh eine bestimmte chemische Spezies hat die Tendenz, Elektronen zu gewinnen und negativ geladene Radikale zu bilden.
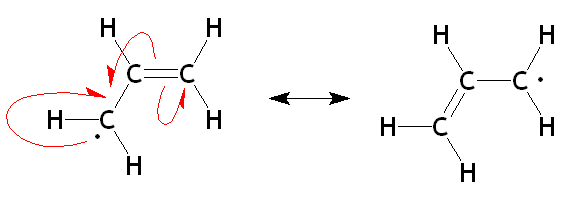
Abbildung 02: Resonanz in Radikalen
Darüber hinaus umfassen einige Beispiele für elektronegative Radikale Chloranion (CL)-), Fluoridanion (f-), usw.
Was ist der Unterschied zwischen elektropositiven und elektronegativen Radikalen?
Radikale sind chemische Spezies wie Atome, Ionen oder Moleküle mit einem ungepaarten Elektron. Der Schlüsselunterschied zwischen elektropositiven und elektronegativen Radikalen besteht darin, dass elektropositive Radikale radikale Verbindungen mit der Kapazität von Elektronen und eine positive Ladung sind, während elektronegative Radikale radikale Verbindungen mit der Kapazität zur Gewinnung von Elektronen und eine negative Ladung sind. Daher tragen elektropositive Radikale eine positive Ladung, während elektronegative Radikale eine negative Ladung tragen. Einige Beispiele für elektropositive Radikale umfassen Kalziumkation und Natriumkation, während die Beispiele für elektronegative Radikale Fluorid- und Chloridionen umfassen.
Die folgende Tabelle fasst den Unterschied zwischen elektropositiven und elektronegativen Radikalen zusammen.

Zusammenfassung -Elektropositive gegen elektronegative Radikale
Ein Radikal in der Chemie ist ein Atom, ein Molekül oder ein Ion, das ein ungepaartes Valenzelektron enthält. Der Hauptunterschied zwischen elektropositiven und elektronegativen Radikalen besteht darin, dass elektropositive Radikale radikale Verbindungen sind, die die Fähigkeit haben, Elektronen zu verlieren und eine positive Ladung zu tragen, während elektronegative Radikale radikale Verbindungen mit der Kapazität zur Gewinnung von Elektronen und eine negative Ladung sind. In den meisten Fällen sind Radikale hochreaktive chemische Spezies, wodurch sie dimerisierende und Polymerisationsreaktionen unterzogen werden.
Referenz:
1. Mehr, Hemant. „Benennung chemischer Verbindungen: Radikale, Ionen, Säuren, Basen, Salze usw.” Der Tatsachenfaktor, 5. Juni 2020, hier erhältlich.
2. „Elektronegativität.” Wikipedia, Wikimedia Foundation, 24. Oktober. 2020, hier erhältlich.
3. „Was ist Elektropositivität? Definition, Trends, Vergleich mit Elektronegativität.Byjus, Byjus, 17. August. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „Antioxidantien freie Radikale Lobo et al.,”Von Lobo, v., Patil, a., Phatak, a., & Chandra, n - Lobo, V., Patil, a., Phatak, a., & Chandra, n. (2010). Freie Radikale, Antioxidantien und funktionelle Lebensmittel: Auswirkungen auf die menschliche Gesundheit. Pharmakognosy Reviews, 4 (8), 118-126. (CC BY-SA 4.0) über Commons Wikimedia
2. "Allylradikale Resonanz" von Orgonaute - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


