Unterschied zwischen ionischen und kovalenten Bindungen
Der Schlüsselunterschied Zwischen ionischen und kovalenten Bindungen ist das Ionenbindungen treten zwischen Atomen auf, die sehr unterschiedliche Elektronegativitäten haben, während kovalente Bindungen zwischen Atomen mit ähnlichen oder sehr niedrigen Elektronegativitätsunterschieden auftreten.
Wie vom amerikanischen Chemiker G vorgeschlagen.N.Lewis schlug vor, dass Atome stabil sind, wenn sie acht Elektronen in ihrer Valenzschale enthalten. Die meisten Atome haben weniger als acht Elektronen in ihren Valenzschalen (mit Ausnahme der edlen Gase in der Gruppe 18 des Periodenzüchtertabels); Daher sind sie nicht stabil. Diese Atome reagieren dazu, miteinander zu reagieren, um stabil zu werden. Somit kann jedes Atom eine edle -gas elektronische Konfiguration erreichen. Ionische und kovalente Bindungen sind die beiden Haupttypen chemischer Bindungen, die Atome in einer chemischen Verbindung verbinden.

INHALT
1. Überblick und wichtiger Unterschied
2. Was sind ionische Bindungen?
3. Wo ist kovalente Bindungen
4. Seite an Seitenvergleich - ionische gegen kovalente Bindungen in tabellarischer Form
5. Zusammenfassung
Was sind ionische Bindungen??
Atome können Elektronen gewinnen oder verlieren und negative oder positive geladene Partikel bilden. was wir Ionen nennen. Es gibt elektrostatische Wechselwirkungen zwischen den Ionen. Ionische Bindung ist die attraktive Kraft zwischen diesen entgegengesetzt geladenen Ionen. Die Elektronegativitäten der Atome in einer ionischen Bindung beeinflussen weitgehend die Stärke der elektrostatischen Wechselwirkungen zwischen Ionen.

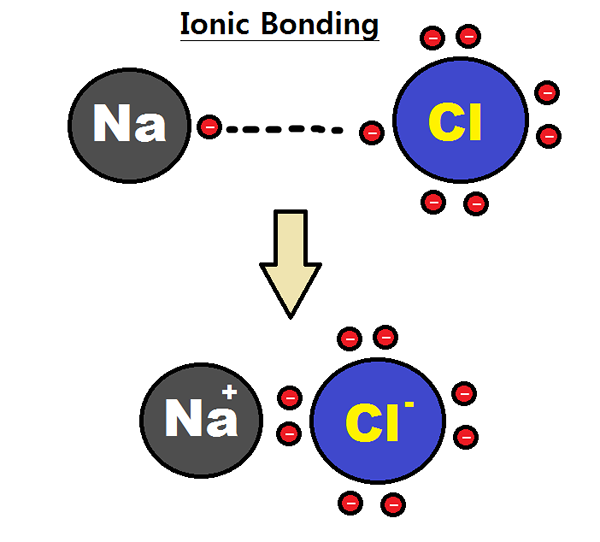
Abbildung 01: Bildung einer ionischen Bindung zwischen Natrium- und Chloratomen
Elektronegativität ist eine Messung der Atome -Affinität zu Elektronen. Ein Atom mit hoher Elektronegativität kann Elektronen aus einem Atom mit geringer Elektronegativität anziehen, um eine ionische Bindung zu bilden. Zum Beispiel hat Natriumchlorid eine ionische Bindung zwischen Natriumion und Chloridion. Natrium ist ein Metall und Chlor ist ein Nichtmetall; Daher hat es eine sehr niedrige Elektronegativität (0.9) im Vergleich zu Chlor (3.0). Aufgrund dieses Elektronegativitätsunterschieds kann Chlor ein Elektron aus Natrium anziehen und CL bilden-. Gleichzeitig bildet Natrium na+ Ionen. Aus diesem Grund erhalten beide Atome die stabile edle gaselektronische Konfiguration. Cl- und na+ werden durch attraktive elektrostatische Kräfte zusammengehalten und so eine ionische Bindung bilden; Na-Cl-Bond.
Was sind kovalente Bindungen?
Wenn zwei Atome mit einem ähnlichen oder sehr niedrigen Elektronegativitätsunterschied zusammen reagieren, bilden sie eine kovalente Bindung, indem sie Elektronen teilen. Auf diese Weise können beide Atome die elektronische Konfiguration von edler Gas erhalten, indem sie Elektronen teilen. Molekül ist das Produkt, das sich aus der Bildung kovalenter Bindungen zwischen Atomen ergibt. Zum Beispiel verbinden Atome desselben Elements, um Moleküle wie CL zu bilden2, H2, oder p4, Jedes Atom bindet über eine kovalente Bindung mit einem anderen.
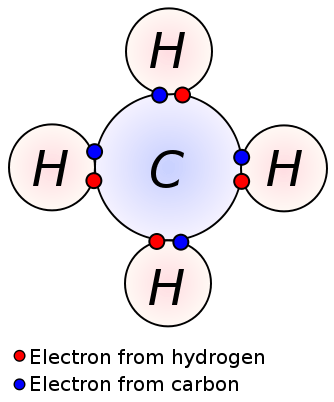
Abbildung 02: kovalente Bindungen zwischen Kohlenstoff- und Wasserstoffatomen im Methanmolekül
Methanmolekül (CH4) hat auch kovalente Bindungen zwischen Kohlenstoff- und Wasserstoffatomen; Es gibt vier kovalente Bindungen zwischen einem zentralen Kohlenstoffatom und vier Wasserstoffatomen (vier C-H-Bindungen). Methan ist ein Beispiel für ein Molekül mit kovalenten Bindungen zwischen Atomen mit sehr geringem Elektronegativitätsunterschied.
Was ist der Unterschied zwischen ionischen und kovalenten Bindungen?
Ionische gegen kovalente Bindungen | |
| Eine chemische Verbindung zwischen zwei Atomen, die durch die elektrostatische Kraft zwischen entgegengesetzt geladenen Ionen in einer ionischen Verbindung verursacht werden. | Ein chemischer Zusammenhang zwischen zwei Atomen oder Ionen, bei denen die Elektronenpaare zwischen ihnen geteilt werden. |
| Anzahl der Atome | |
| Zwischen Metallen und Nichtmetallen auftreten. | Am häufigsten tritt zwischen zwei Nichtmetallen auf. |
| Anzahl der Elektronen | |
| Eine vollständige Übertragung von Elektronen erfolgt. | Tritt auf, wenn zwei (oder mehr) Elemente Elektronen teilen. |
| Verbindungen | |
| Normalerweise als Kristalle angesehen, bei denen nur wenige positiv geladene Ionen ein negativ geladenes Ion umgeben. | Die durch kovalenten Bindungen gebundenen Atome existieren als Moleküle, die bei Raumtemperatur hauptsächlich als Gase oder Flüssigkeiten existieren. |
| Polarität | |
| Ionische Bindungen haben eine hohe Polarität. | Kovalente Bindungen haben eine geringe Polarität. |
| Physikalische Eigenschaften | |
| Ionenverbindungen haben sehr hohe Schmelzpunkte und Siedepunkte im Vergleich zu kovalenten Molekülen. | Kovalente Moleküle haben niedrige Schmelzpunkte und Siedepunkte im Vergleich zu ionischen Verbindungen. |
| Wasserlöslichkeit | |
| In polaren Lösungsmitteln (wie Wasser) lösen ionische Verbindungen die Freisetzung von Ionen auf; Solche Lösungen sind in der Lage, Elektrizität durchzuführen. | In polaren Lösungsmitteln lösen sich kovalente Moleküle nicht erheblich auf; Daher sind diese Lösungen nicht in der Lage, Elektrizität durchzuführen. |
Zusammenfassung -ionische gegen kovalente Bindungen
Ionische und kovalente Bindungen sind die Haupttypen chemischer Bindungen, die in Verbindungen existieren. Der Unterschied zwischen ionischer und kovalenter Bindung besteht darin, dass ionische Bindungen zwischen Atomen auftreten.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Ionenbindungsdefinition.”Thoughtco, Februar. 10, 2017. Hier verfügbar
2. Helmenstine, Anne Marie, ph.D. „Kovalente Bindungsdefinition.”Thoughtco, Februar. 7, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Ionicbondingrh11'By Rhannosh - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia
2.'Covalent'By Dynablast - erstellt mit Inkscape (CC BY -SA 2.5) über Commons Wikimedia


