Unterschied zwischen ionischen und kovalenten Verbindungen
Schlüsselunterschied - ionische gegen kovalente Verbindungen
Viele Unterschiede können zwischen ionischen und kovalenten Verbindungen anhand ihrer makroskopischen Eigenschaften wie Löslichkeit in Wasser, elektrischer Leitfähigkeit, Schmelzpunkten und Siedepunkt. Der Hauptgrund für diese Unterschiede ist der Unterschied in ihrem Bindungsmuster. Deshalb ihre Bindungsmuster kann als die angesehen werden Schlüsselunterschied zwischen ionische und kovalente Verbindungen. (Differenz zwischen ionischen und kovalenten Bindungen) Wenn ionische Bindungen gebildet werden. Sie bilden aufgrund der elektrostatischen Anziehung eine starke Bindung. Es werden kovalente Bindungen zwischen zwei Nichtmetallen gebildet. In der kovalenten Bindung teilen zwei oder mehr Atome Elektronen, um die Oktettregel zu erfüllen. Im Allgemeinen sind ionische Bindungen stärker als kovalente Bindungen. Dies führt zu den Unterschieden in ihren physikalischen Eigenschaften.
Was sind ionische Verbindungen?
Ionenbindungen werden gebildet, wenn zwei Atome einen großen Unterschied in ihren Elektronegativitätswerten haben. Bei der Bildung von Bindungen erhält die weniger elektronegativen Atomverluste Elektronen (en) und mehr elektronegatives Atom diese Elektronen (en). Daher sind resultierende Arten entgegengesetzt geladene Ionen und bilden aufgrund der starken elektrostatischen Anziehung eine Bindung.
Ionische Bindungen werden zwischen Metallen und Nichtmetallen gebildet. Im Allgemeinen haben Metalle nicht viele Valenzelektronen in der äußersten Hülle; Nichtmetalle haben jedoch näher an acht Elektronen in der Valenzschale. Daher neigen Nicht-Metalle dazu, Elektronen zu akzeptieren, um die Oktettregel zu erfüllen.
Beispiel einer ionischen Verbindung ist na+ + Cl- à nacl
Natrium (Metall) hat nur ein Valenzelektron und Chlor (Nicht-Metal) hat sieben Valenzelektronen. 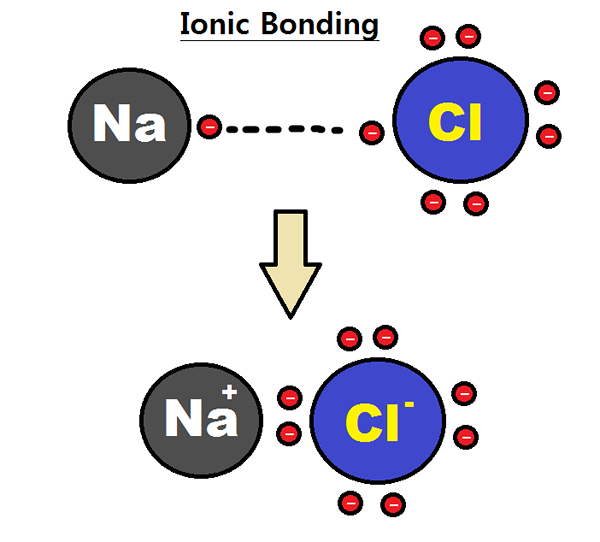
Was sind kovalente Verbindungen?
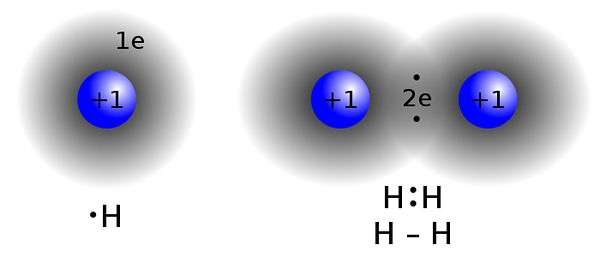
Kovalente Verbindungen werden gebildet, indem Elektronen zwischen zwei oder mehr Atomen geteilt werden, um die „Oktett -Regel“ zu erfüllen. Dieser Bindungsart ist üblich.Zwei Atome mit fast den gleichen Elektronegativitätswerten tauschen keine Elektronen aus ihrer Valenzschale aus (spenden / empfangen). Stattdessen teilen sie Elektronen, um eine Oktettkonfiguration zu erreichen.
Beispiele für kovalente Verbindungen sind Methan (ch4), Kohlenmonoxid (CO), Jodmonobromid (IBR)

Kovalente Bindung
Was ist der Unterschied zwischen ionischen und kovalenten Verbindungen?
Definition von ionischen Verbindungen und kovalenten Verbindungen
Ionische Verbindung: Ionische Verbindung ist eine chemische Verbindung von Kationen und Anionen, die durch ionische Bindungen in einer Gitterstruktur zusammengehalten werden.
Kovalente Verbindung: Kovalente Verbindung ist eine chemische Bindung, die durch das Teilen eines oder mehrerer Elektronen, insbesondere der Elektronenpaare, zwischen Atomen gebildet wird.
Eigenschaften ionischer und kovalenter Verbindungen
Physikalische Eigenschaften
Ionische Verbindungen:
Alle ionischen Verbindungen existieren als Feststoffe bei Raumtemperatur.
Ionenverbindungen haben eine stabile Kristallstruktur. Daher haben sie höhere Schmelzpunkte und Siedepunkte. Die Anziehungskräfte zwischen positiven und negativen Ionen sind sehr stark.
| Ionische Verbindung | Aussehen | Schmelzpunkt |
| NaCl -Natriumchlorid | Weißer kristalline Feststoff | 801 ° C |
| KCL - Kaliumchlorid | Weißer oder farbloser Glaskristall | 770 ° C |
| Mgcl2- Magnesiumchlorid | Weißer oder farbloser kristalline Feststoff | 1412 ° C |
Kovalente Verbindungen:
In allen drei Formen existieren kovalente Verbindungen; als Feststoffe, Flüssigkeiten und Gase bei Raumtemperatur.
Ihre Schmelz- und Siedepunkte sind im Vergleich zu den ionischen Verbindungen relativ niedrig.
| Kovalente Verbindung | Aussehen | Schmelzpunkt |
| HCl-Hydrogen-Chlorid | Ein farbloses Gas | -114.2 ° C |
| CH4 -Methan | Ein farbloses Gas | -182 ° C |
| CCL4 - Tetrachlorkohlenstoff | Eine farblose Flüssigkeit | -23 ° C |
Leitfähigkeit
Ionische Verbindungen: Feste ionische Verbindungen haben keine freien Elektronen; Daher leiten sie keinen Strom in fester Form. Wenn jedoch ionische Verbindungen in Wasser gelöst sind, machen sie eine Lösung, die Strom leitet. Mit anderen Worten, wässrige Lösungen ionischer Verbindungen sind gute elektrische Leiter.
Kovalente Verbindungen: Weder reine kovalente Verbindungen noch gelöste Formen in Wasser leiten keinen Strom leiten. Daher sind kovalente Verbindungen schlechte elektrische Leiter in allen Phasen.
Löslichkeit
Ionische Verbindungen: Die meisten ionischen Verbindungen sind in Wasser löslich, aber in nichtpolaren Lösungsmitteln unlöslich.
Kovalente Verbindungen: Die meisten kovalenten Verbindungen sind in nichtpolaren Lösungsmitteln löslich, jedoch nicht in Wasser.
Härte
Ionische Verbindungen: Ionische Feststoffe sind härtere und spröde Verbindungen.
Kovalente Verbindungen: Im Allgemeinen sind kovalente Verbindungen weicher als ionische Feststoffe.
Bild mit freundlicher Genehmigung: „Kovalente Bindungswasserstoff“ von Jacek FH - eigene Arbeit. (CC BY-SA 3.0) über Commons „Ionicbondingrh11“ von Rhannosh - eigene Arbeit. (CC BY-SA 3.0) über Wikimedia Commons

