Unterschied zwischen ionischen und elektrostatischen Wechselwirkungen
Der Schlüsselunterschied Zwischen ionischen und elektrostatischen Wechselwirkungen ist das Ionenwechselwirkungen beschreiben die Anziehungskraft zwischen zwei gegenüberliegenden ionischen Spezies. In der Zwischenzeit beschreiben elektrostatische Wechselwirkungen die Anziehungskraft zwischen zwei vollständig oder teilweise ionisierten Arten mit entgegengesetzten Ladungen.
Ionische und elektrostatische Wechselwirkungen sind sehr wichtige chemische Konzepte, die bei der Bestimmung des Aufbaus von Molekülen hilfreich sind. Diese werden auch als nichtkovalente Bindungen bezeichnet. Kovalente chemische Bindungen bilden sich aufgrund der Elektronenfreigabe zwischen Atomen. Es bilden sich jedoch aufgrund der Anziehungskraft geladener Arten, die entgegengesetzte elektrische Ladungen entgegengesetzt sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind ionische Wechselwirkungen?
3. Was sind elektrostatische Wechselwirkungen?
4. Seite an Seite Vergleich - ionische und elektrostatische Wechselwirkungen in tabellarischer Form
5. Zusammenfassung
Was sind ionische Wechselwirkungen??
Ionische Wechselwirkungen sind ionische Bindungen. Es ist eine Art nichtkovalenter Bindung. Darüber hinaus beinhaltet es vollständig geladene chemische Arten (nicht teilweise geladene Arten). Dies ist die primäre Art der chemischen Bindung, die in ionischen Verbindungen auftritt.
Ionen sind Atome oder eine Gruppe von Atomen, die Elektronen entweder gewonnen oder entfernt haben; Dies macht sie elektrisch geladene Arten. Anionen und Kationen sind die beiden Arten von Ionen. Anionen gebildet aufgrund von Elektronenzuwachs, während Kationen aufgrund der Elektronenentfernung gebildet werden. Daher werden Anionen aufgrund des Vorhandenseins von überschüssigen Elektronen negativ aufgeladen, während Kationen aufgrund des Mangels an Elektronen zur Neutralisierung der Ladung von Protonen positiv aufgeladen werden.
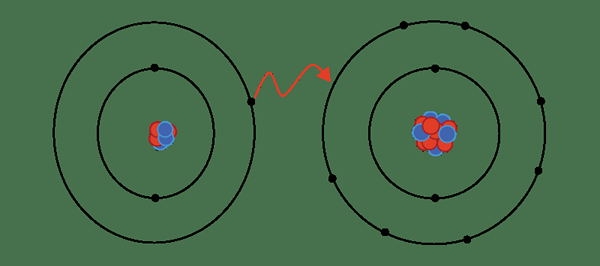
Eine ionische Bindung bildet sich, wenn das Elektron aus einem Atom (oder einer Gruppe von Atomen) entfernt wird, um ein Kation zu bilden. Im einfachsten Sinne bildet sich eine ionische Bindung, wenn ein Elektron aus einem Metall entfernt wird, und ein Nicht -Metall fängt dieses Elektron ein, um einen Anion zu bilden.

Abbildung 01: Bildung einer ionischen Bindung
Alle ionischen Bindungen haben jedoch einen gewissen Grad an kovalenten Eigenschaften, da kein Atom ein Elektron vollständig entfernen kann. Daher sollten wir verstehen, dass sich der Begriff ionische Wechselwirkung auf den Moment bezieht, in dem der ionische Charakter im Vergleich zum kovalenten Charakter größer ist.
Fast alle ionischen Verbindungen sind feste Verbindungen, da die ionischen Wechselwirkungen stark genug sind, um die Anionen und Kationen fest zusammenzuhalten. Geschmolzene ionische Verbindungen können jedoch Elektrizität leiten, da sie Ionen enthält, die Ladungen tragen können. Darüber hinaus führt die hohe Stärke ionischer Wechselwirkungen dazu, dass die ionischen Verbindungen sehr hohe Schmelzpunkte haben.
Was sind elektrostatische Wechselwirkungen??
Elektrostatische Wechselwirkungen sind eine Art Anziehungskräfte, bei denen vollständige oder teilweise ionische Arten voneinander angezogen werden. Darüber hinaus umfasst dieser Begriff sowohl attraktive als auch abstoßende Kräfte zwischen ionischen Arten, ich.e. Gegenseitig geladene Ionen werden voneinander angezogen. Diese werden auch als nichtkovalente Bindungen bezeichnet, da die Anziehungskraft keine Elektronenfreigabe zwischen Atomen umfasst. Es gibt drei verschiedene Arten von elektrostatischen Wechselwirkungen: ionische Wechselwirkungen, Wasserstoffbrückenbindung und Halogenbindung.
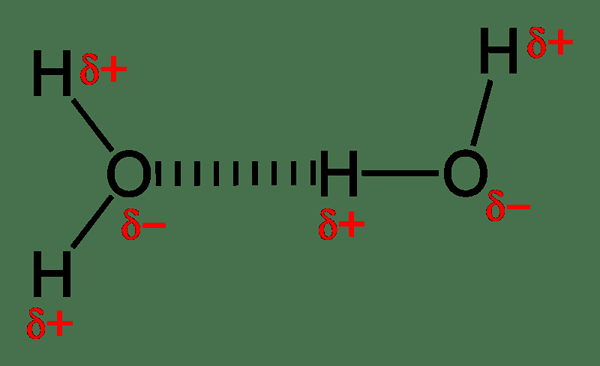
Abbildung 02: Wasserstoffbrückenbindung ist eine Art elektrostatischer Wechselwirkung
Die ionische Wechselwirkung umfasst die Anziehungskraft zwischen vollständig ionisierten chemischen Spezies mit entgegengesetzten Ladungen, e.G. Anionen ziehen Kationen an. Diese Wechselwirkungen verursachen die Bildung ionischer Verbindungen. Diese Interaktionskräfte sind sehr stark; Daher existieren ionische Verbindungen im Festkörperzustand. Die Wasserstoffbrücke ist eine andere Art der elektrostatischen Wechselwirkung, bei der wir eine Dipol-Dipol-Wechselwirkung beobachten können. Diese Anziehungskraft besteht zwischen einem Wasserstoffatom (das teilweise positiv ist) und einem hoch elektronegativen Atom (das teilweise negativ ist). Darüber hinaus ist die Halogenbindung auch wie eine Wasserstoffbrückenbindung, aber der Unterschied ist die Wechselwirkung, die zwischen einem Halogen und einem Elektrophil besteht.
Was ist der Unterschied zwischen ionischen und elektrostatischen Wechselwirkungen?
Ionenwechselwirkungen und elektrostatische Wechselwirkungen sind nichtkovalente chemische Bindungen. Diese sind sehr wichtig, um die Bildung verschiedener Moleküle zu beschreiben. Der Schlüsselunterschied zwischen ionischen und elektrostatischen Wechselwirkungen besteht darin, dass ionische Wechselwirkungen die Anziehungskraft zwischen zwei gegenüberliegenden ionischen Spezies beschreiben, während elektrostatische Wechselwirkungen die Anziehungskraft zwischen zwei vollständig oder teilweise ionisierten Spezies mit entgegengesetzten Ladungen beschreiben.
Die folgende Infografik fasst den Unterschied zwischen ionischen und elektrostatischen Wechselwirkungen zusammen.

Zusammenfassung -ionische gegen elektrostatische Wechselwirkungen
Ionenwechselwirkungen und elektrostatische Wechselwirkungen sind nichtkovalente chemische Bindungen. Diese sind sehr wichtig, um die Bildung verschiedener Moleküle zu beschreiben. Der Schlüsselunterschied zwischen ionischen und elektrostatischen Wechselwirkungen besteht darin, dass ionische Wechselwirkungen die Anziehungskraft zwischen zwei gegenüberliegenden ionischen Spezies beschreiben, während elektrostatische Wechselwirkungen die Anziehungskraft zwischen zwei vollständig oder teilweise ionisierten Spezies mit entgegengesetzten Ladungen beschreiben.
Referenz:
1. Helmenstine, Anne Marie. „Ionenbindungsdefinition.”Thoughtco, Jan. 26, 2019, hier erhältlich.
2. Helmenstine, Anne Marie. „Chemiedefinitionen: Was sind elektrostatische Kräfte?”Thoughtco, Oktober. 5, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Ionische Bindung" von Eliseetc / Vectorised aus der ionischen Bindung.PNG - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "Wasserstoffbrückenbindungen-in-Wasser-2D" (Public Domain) über Commons Wikimedia


