Unterschied zwischen ionischen und molekularen Feststoffen
Schlüsselunterschied - ionisch vs molekulare Feststoffe
Feste Substanzen sind Verbindungen, die in einem Feststoffzustand bei einer bestimmten Temperatur und einem bestimmten Druck existieren. Festkörpermittel bedeutet, dass Atome, Moleküle oder Ionen in dieser Substanz eng gepackt sind und die Bewegung dieser chemischen Spezies vermeiden (im Gegensatz zu Flüssigkeiten oder Gasen). Es gibt zwei Haupttypen fester Substanzen; ionische Feststoffe und molekulare Feststoffe. Ionische Verbindungen enthalten Ionen, die über ionische chemische Bindungen zusammengehalten werden. Ionische Bindungen sind elektrostatische Anziehungskräfte zwischen entgegengesetzt geladenen Ionen. Molekulare Feststoffe sind feste Substanzen, die diskrete Moleküle enthalten, die über Van der Waal -Kräfte zusammengehalten werden. Der Schlüsselunterschied zwischen ionischen Feststoffen und molekularen Feststoffen ist das Ionen Feststoffe enthalten ionische chemische Bindungen, während molekularer Feststoff van der Waal -Kräfte enthalten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind ionische Feststoffe
3. Was sind molekulare Feststoffe
4. Seite an Seitenvergleich - ionische und molekulare Feststoffe in tabellarischer Form
5. Zusammenfassung
Was sind ionische Feststoffe?
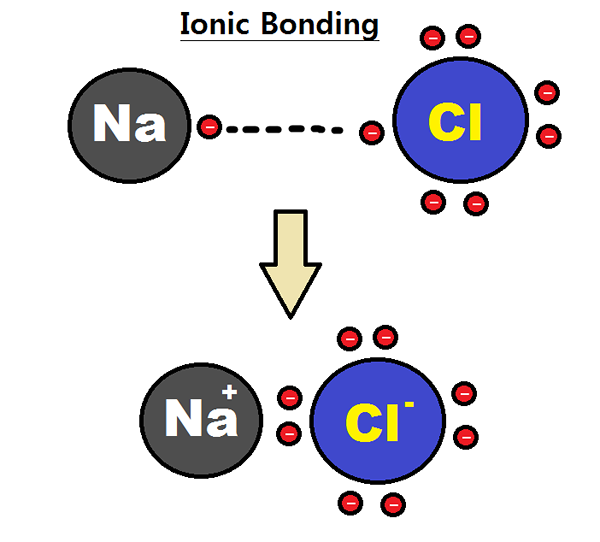
Ionische Feststoffe sind feste Verbindungen, die aus entgegengesetzt geladenen Ionen bestehen, die durch elektrostatische Attraktionen zusammengehalten werden. Die Ionen sind positiv geladene Ionen, die Kationen und negativ geladene Ionen sind, die als Anionen bezeichnet werden. Die chemische Bindung zwischen diesen Ionen ist als ionische Bindung bekannt. Die Gesamtladung des ionischen Feststoffs ist neutral. Das liegt daran, dass die Kationen von Anionen umgeben sind und umgekehrt.
Ionische Feststoffe können entweder einfache Ionen wie Na enthalten+ und Cl- oder komplexe Ionen wie Ammoniumion (NH4+). Ionische Feststoffe, die h enthalten+ Ionen werden als saure Verbindungen bezeichnet, weil diese Feststoffe H freisetzen+ Ionen in Wasser gelöst (es reduziert den pH -Wert des wässrigen Mediums). Ionische Feststoffe mit OH- Ionen werden als Grundverbindungen bezeichnet, weil sie OH freigeben- Ionen (es erhöht den pH).
Ionische Feststoffe haben typischerweise hohe Schmelzpunkte und Siedepunkte. Diese Feststoffe sind hart und spröde. Wenn ionische Feststoffe geschmolzen sind, wird sie hoch leitend, da die geschmolzene Form von ionischen Verbindungen Ionen enthält, die Elektrizität leiten können. Ionische Feststoffe können durch verschiedene Prozesse wie Verdampfung, Niederschlag, Einfrieren usw. gebildet werden.

Abbildung 01: Bildung einer ionischen Bindung
Typischerweise haben ionische Feststoffe regelmäßige kristalline Strukturen. Dort sind die Ionen so stark gepackt, dass die Gitterenergie minimiert wird. Gitterenergie ist die Menge an Energie, die erforderlich ist, um ein Gitter aus vollständig getrennten Ionen zu bilden.
Was sind molekulare Feststoffe?
Ein molekularer Feststoff ist eine Art von Feststoff, bei der Moleküle eher durch Van -der -Waals -Kräfte als durch ionische oder kovalente Bindungen zusammengehalten werden. Ein molekularer Feststoff enthält diskrete Moleküle. Die Van der Waal -Kräfte, die diese Moleküle miteinander binden, sind schwächer als kovalente oder ionische Bindungen. Die in diesen molekularen Festkörpern vorhandenen Moleküle können monoatomisch, zweiatomisch oder sogar polyatomisch sein.
Da die intermolekularen Kräfte in den molekularen Feststoffen sehr schwach sind, haben diese festen Verbindungen niedrigere Schmelzpunkte (oft sind sie weniger als 300 ° C). Und auch diese molekularen Feststoffe sind relativ weich und haben niedrigere Dichten. Es kann jedoch Wasserstoffbrückenbindungen, Dipol-Dipol-Wechselwirkungen, Londoner Streitkräfte usw. geben. auch (anstelle von Van der Waal -Kräften).
Van der Waal -Kräfte können zwischen unpolaren Molekülen beobachtet werden. Dipol-Dipol-Wechselwirkungen können in polaren Molekülen beobachtet werden. Wasserstoffbrückenbindungen zwischen Molekülen, die funktionelle Gruppen wie O-H, N-H und F-H enthalten, sind vorhanden.
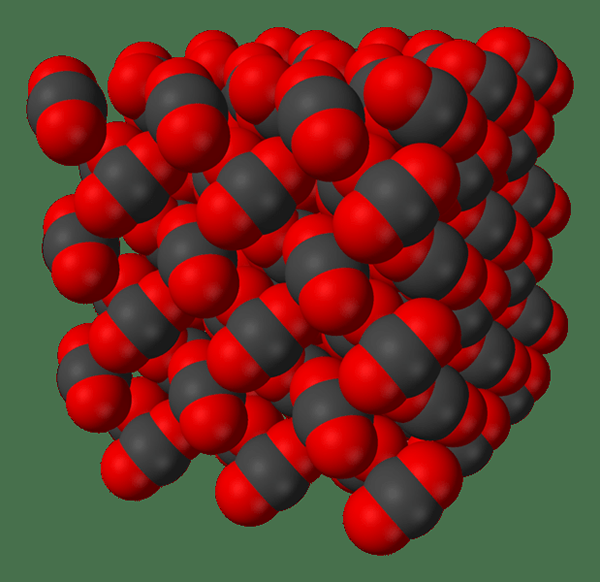
Abbildung 02: Ein Diagramm, das Kohlendioxidmoleküle in fester Form zeigt
Die schwachen Van der Waal -Kräfte zwischen den Molekülen in molekularen Festkörpern bestimmen die Eigenschaften des Feststoffs. Einige dieser Eigenschaften umfassen niedrige Schmelz- und Siedepunkte, niedrige mechanische Festigkeit, niedrige elektrische Leitfähigkeit, niedrige thermische Leitfähigkeit usw.
Was ist der Unterschied zwischen ionischen und molekularen Feststoffen?
Ionische gegen molekulare Feststoffe | |
| Ionische Feststoffe sind feste Verbindungen, die aus entgegengesetzt geladenen Ionen bestehen, die durch elektrostatische Attraktionen zusammengehalten werden. | Ein molekularer Feststoff ist eine Art von Feststoff, bei der Moleküle eher durch Van -der -Waals -Kräfte als durch ionische oder kovalente Bindungen zusammengehalten werden. |
| Chemische Bindungen | |
| Ionische Feststoffe haben ionische Bindungen. | Molekulare Feststoffe haben hauptsächlich Van der Waal-Kräfte, und es können Wasserstoffbrückenbindungen, Dipol-Dipol-Wechselwirkungen, Londoner Kräfte usw. geben. sowie. |
| Haftfestigkeit | |
| Ionische Feststoffe haben starke Bindungen. | Molekulare Feststoffe haben schwache Bindungen. |
| Komponenten | |
| Ionische Feststoffe haben Kationen und Anionen. | Molekulare Feststoffe haben polare oder unpolare Moleküle. |
| Schmelz- und Siedepunkte | |
| Ionische Feststoffe haben hohe Schmelz- und Siedepunkte. | Molekulare Feststoffe haben niedrige Schmelz- und Siedepunkte. |
| Dichte | |
| Die Dichte der ionischen Feststoffe ist sehr hoch. | Die Dichte von molekularen Feststoffen ist sehr niedrig. |
| Natur | |
| Ionische Feststoffe sind hart und spröde. | Molekulare Feststoffe sind relativ weich. |
Zusammenfassung -ionisch vs molekulare Feststoffe
Ionische Feststoffe sind feste Verbindungen aus Kationen und Anionen. Es gibt elektrostatische Anziehungskräfte zwischen diesen entgegengesetzt geladenen Ionen. Molekulare Feststoffe haben Moleküle, die intermolekulare Kräfte haben. Sie sind schwache chemische Wechselwirkungen. Der Unterschied zwischen ionischen Feststoffen und molekularen Feststoffen besteht darin.
Referenz:
1.Helmenstine, Anne Marie, D. „Molekulare Festkörperdefinition und Beispiele.”Thoughtco, Februar. 19, 2017. Hier verfügbar
2.„Ionische Feststoffe.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar
3.„Molekularer Feststoff.”Wikipedia, Wikimedia Foundation, 27. Februar. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Ionicbondingrh11'By Rhannosh - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia
2.'Kohlendioxidkristall-3D-VDW'By Ben Mills-eigene Arbeit, (Public Domain) über Commons Wikimedia