Unterschied zwischen kritischem und dreifachem Punkt
Schlüsselunterschied - kritischer Punkt vs Verdreifachen Punkt
Kritischer Punkt und dreifacher Punkt sind Begriffe, mit denen Temperaturen und Drucke erklärt werden, bei denen zwei oder mehr Substanzen miteinander koexistieren können. Der kritische Punkt ist der Zustand, bei dem die Flüssigkeits- und Dampfphase derselben Substanz koexistiert. Der dreifache Punkt ist der Zustand, bei dem alle drei Materiephasen miteinander koexistieren können. Der Schlüsselunterschied Zwischen einem kritischen Punkt und dem dreifachen Punkt ist das Der kritische Punkt beschreibt die Koexistenz zweier Phasen derselben Substanz, während der Triple Point die Koexistenz von drei Phasen derselben Substanz beschreibt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist kritischer Punkt
3. Was ist dreifacher Punkt
4. Ähnlichkeiten zwischen kritischem und dreifachem Punkt
5. Seite für Seitenvergleich - kritischer Punkt gegenüber dreifacher Punkt in tabellarischer Form
6. Zusammenfassung
Was ist kritischer Punkt?
Der kritische Punkt einer Substanz ist der Endpunkt der Phasengleichgewichtskurve dieser Substanz. Eine Phasengleichgewichtskurve oder ein Phasendiagramm ist der Druckdiagramm gegen die Temperatur, bei der die Phasenänderungen der Substanz gezeigt werden. Dies zeigt die Temperaturen und den Druck, bei dem die Substanz als Feststoff, Flüssigkeit oder Gas existiert. Der kritische Punkt ist die Temperatur und den Druck, bei dem die Flüssigkeit und die Dampfphase koexistieren.

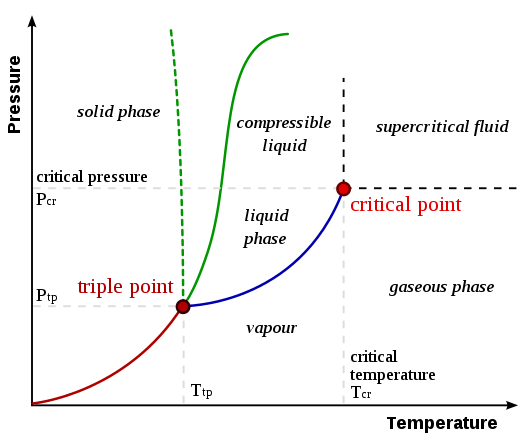
Abbildung 01: Ein Phasendiagramm, das sowohl kritischen als auch dreifachen Punkt zeigt
Die Temperatur und der Druck an kritischem Punkt werden als kritische Temperatur (TC) und kritischer Druck (PC) bezeichnet. Wie im obigen Bild gezeigt, werden die Linien zwischen zwei Phasen als Grenzen bezeichnet. Ein kritischer Punkt zeigt den Punkt an, an dem Liniengrenzen verschwinden.
Es ist manchmal sehr wichtig, den kritischen Punkt einer Substanz zu kennen. Zum Beispiel kann ein Gas niemals bei Temperaturen und Drücken über seinem kritischen Punkt kondensiert werden. Dies liegt daran, dass die intermolekularen Kräfte zwischen Gasmolekül bei sehr hohen Temperaturen geschwächt werden.
Es gibt zwei Arten des kritischen Punktes;
-
Flüssig-vapour-kritischer Punkt
Dies ist ein typischer kritischer Punkt, an dem der Dampf einer Substanz mit seiner flüssigen Form zusammen ist. Der kritische Wasserpunkt liegt bei 647 K und 22.064 MPA.
-
Flüssiger liquid kritischer Punkt
Diese Art von kritischen Punkten ist für Lösungen definiert. Es ist die Temperatur und den Druck, bei dem ein Lösungsgemisch in zwei unterschiedliche Flüssigkeitsphasen getrennt ist.
Was ist dreifacher Punkt?
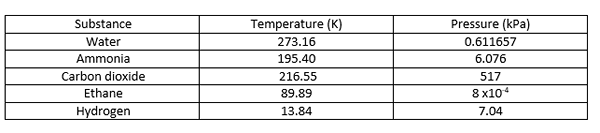
Der dreifache Punkt ist die Temperatur und der Druck, bei dem feste, flüssige und Dampfphasen eines bestimmten Substanz im Gleichgewicht zusammenkommen. Es beschreibt einen spezifischen thermodynamischen Zustand der Matte. Manchmal kann der Dreifachpunkt mehr als eine feste Phase beinhalten, wenn es Polymorphe der Substanz gibt. In einem Phasendiagramm ist der dreifache Punkt der Punkt, an dem sich alle drei Grenzlinien miteinander treffen. Einige Beispiele für dreifache Punkte sind unten angegeben.
Was sind die Ähnlichkeiten zwischen kritischem und dreifachem Punkt??
- Sowohl kritische als auch dreifache Punkt beschreiben bestimmte spezifische Temperaturen und Drucke.
- Sowohl kritischer Punkt als auch Dreifachpunkt beschreiben Gleichgewichtszustände, in denen zwei oder mehr physikalische Zustände eines Substanz koexistieren.
Was ist der Unterschied zwischen kritischem und dreifachem Punkt?
Kritischer Punkt gegen dreifache Punkte | |
| Der kritische Punkt einer Substanz ist der Endpunkt der Phasengleichgewichtskurve dieser Substanz. | Der dreifache Punkt ist die Temperatur und der Druck, bei dem feste, flüssige und Dampfphasen eines bestimmten Substanz im Gleichgewicht zusammenkommen. |
| Phasen | |
| Der kritische Punkt beschreibt die Koexistenz zweier Phasen derselben Substanz. | Triple Point beschreibt die Koexistenz von drei Phasen derselben Substanz. |
| Wasser als Beispiel | |
| Der kritische Wasserpunkt liegt bei 647 K und 22.064 MPA. | Der dreifache Wasserpunkt liegt bei 273.16 K und 0.611657 MPA. |
| Phasendiagramm | |
| Der kritische Punkt ist der Endpunkt einer Phasendiagrammkurve. | Triple Point ist der Punkt, an dem sich die gesamte Grenzlinie miteinander trifft. |
Zusammenfassung - Kritischer Punkt vs Verdreifachen Punkt
Kritischer Punkt einer Substanz ist der Endpunkt der Phasengleichgewichtskurve dieser Substanz, die die Temperatur und den Druck ergibt, bei dem die Flüssigkeits- und Dampfphase eines Substanz miteinander existieren können. Der Dreifachpunkt gibt die Temperatur und den Druck an, bei dem alle drei Materiephasen miteinander koexistieren können. Der Unterschied zwischen einem kritischen Punkt und dem dreifachen Punkt besteht darin.
Referenz:
1.Helmenstine, Anne Marie, D. „Triple Point Definition und Beispiel (Chemie).”Thoughtco, Nov. 10, 2017. Hier verfügbar
2."Dreifacher Punkt.Wikipedia, Wikimedia Foundation, 6. März. 2018. Hier verfügbar
3."Kritischer Punkt.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Phase-diag2' von Matthieumarechal (CC BY-SA 3.0) über Commons Wikimedia