Unterschied zwischen Isoelektronik und Isosteren
Der Schlüsselunterschied Zwischen Isoelektronik und Iosteren befindet sich die Isoelektronische chemische Spezies haben ähnliche elektronische Konfigurationen, während die Isostere chemische Spezies mit einer ähnlichen Größe, der gleichen Anzahl von Atomen und Valenzelektronen sind.
Das Präfix „ISO-“ bedeutet, dass zwei oder mehr chemische Arten das gleiche charakteristische Merkmal haben. Isoelektronische Arten und Isostere sind zwei solcher Arten von Merkmalen. Diese beiden Begriffe unterscheiden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist isoelektronisch
3. Was sind Isostere?
4. Seite für Seitenvergleich -Isoelektronische gegen Isostere in tabellarischer Form
5. Zusammenfassung
Was ist isoelektronisch?
Der Begriff isoelektronischer Begriff bezieht sich auf die gleiche Anzahl von Elektronen oder die gleiche elektronische Konfiguration. Die chemischen Spezies, die wir in diesem Zusammenhang betrachten, umfassen Atome, Ionen oder Moleküle. Diese chemischen Spezies sollten die gleiche elektronische Struktur der gleichen Anzahl von Valenzelektronen haben, um sie als isoelektronische Spezies zu nennen. Mit anderen Worten, dieser Begriff bezieht sich auf die Funktion „Gleiche elektrische“ oder gleiche Ladung. Typischerweise zeigen diese chemischen Spezies auch ähnliche chemische Eigenschaften, da die chemischen Eigenschaften chemischer Spezies durch die elektronische Konfiguration der chemischen Spezies bestimmt werden.
Wenn einige Beispiele für isoelektronische chemische Spezies in Betracht gezogen werden, wäre ein häufiges Beispiel das Atom und das Li+ (Lithiumkation), bei dem beide chemischen Spezies zwei Elektronen in ihren Atomen/Ion haben. In ähnlicher Weise sind K+ (Kaliumkation) und Ca+ 2 (Kalziumkation) isoelektronisch, da beide Kationen die elektronische Konfiguration [NE] 4S1 haben. Zusätzlich zu Atomen/Ion können wir auch einige Beispiele für Moleküle angeben, die isoelektronisch miteinander sind, einschließlich Kohlenmonoxidmolekül und Stickstoffgasmolekül.
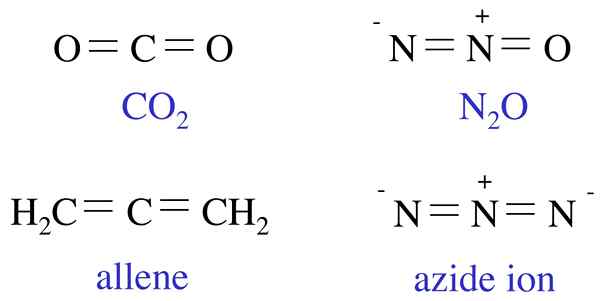
Abbildung 01: Beispiele für isoelektronische Moleküle
Das Konzept der isoelektronischen Natur chemischer Spezies ist nützlich bei der Vorhersage der Eigenschaften und Reaktionen einer chemischen Spezies. Wir können dieses Merkmal verwenden, um Atome ähnlich wie Wasserstoff mit einem Valenzelektron zu identifizieren und daher isoelektronisch für Wasserstoff zu. Darüber hinaus können wir dieses Konzept anwenden, um unbekannte oder seltene Verbindungen in Abhängigkeit von ihrer elektronischen Ähnlichkeit mit einer bekannten/gemeinsamen chemischen Spezies zu identifizieren.
Was sind Isostere??
Der Begriff Isostere bezieht sich auf chemische Arten mit einer ähnlichen Größe, der gleichen Anzahl von Atomen und der gleichen Anzahl von Valenzelektronen. Die chemischen Spezies, die wir in diesem Zusammenhang betrachten, sind Moleküle oder Ionen. Zum Beispiel sind Benzol und Thiophen isosterische Moleküle. Im Allgemeinen haben isosterische Moleküle aufgrund ihrer identischen Elektronenanordnung die gleiche Form. Oft haben diese chemischen Arten auch ähnliche elektronische Eigenschaften. Das Konzept der Iosteren wurde erstmals 1919 von Irving Langmuir entwickelt. Später wurde es von Grimm modifiziert.
Was ist der Unterschied zwischen Isoelektronik und Isosteren?
Der wichtigste Unterschied zwischen Isoelektronik und Isosteren besteht darin, dass die isoelektronischen chemischen Spezies ähnliche elektronische Konfigurationen aufweisen, während die Isostere chemische Spezies mit einer ähnlichen Größe, der gleichen Anzahl von Atomen und Valenzelektronen sind. Darüber hinaus beschreiben die Isoelektronik Atome, Ionen oder Moleküle, während die Isostere Ionen oder Moleküle beschreiben. Zum Beispiel sind Kohlenmonoxidgas und Stickstoffgas isoelektronisch zueinander, während Benzol und Thiophen Isostere sind.
Die folgende Infografik fasst die Unterschiede zwischen isoelektronischen und isosteren in tabellarischer Form für Seite für Seitenvergleich zusammen.
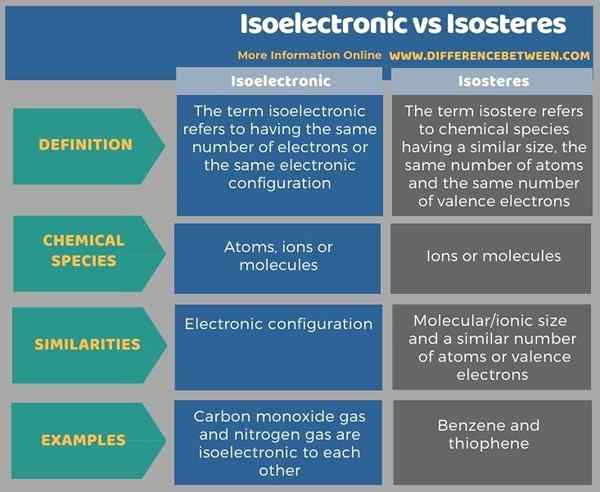
Zusammenfassung -Isoelektronische gegen Isostere
Der Begriff isoelektronischer Begriff unterscheidet sich von dem Begriff Isostere, da sie zwei verschiedene Merkmale chemischer Arten beschreiben. Der Hauptunterschied zwischen Isoelektronik und Isosteren besteht darin, dass isoelektronische chemische Spezies ähnliche elektronische Konfigurationen aufweisen, während Isostere chemische Spezies mit einer ähnlichen Größe, der gleichen Anzahl von Atomen und Valenzelektronen sind.
Referenz:
1. Helmenstine, Anne Marie. „Isoelektronische Definition.”Thoughtco, August. 28, 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Isoelektronische Moleküle" von TEM5PSU - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


