Unterschied zwischen isotonisch und isosmotisch
Der Schlüsselunterschied zwischen isotonisch und isosmotisch ist das Isotonische Lösungen enthalten nur nicht durchdringende gelöste Stoffe, während isosmotische Lösungen sowohl durchdringende als auch nicht penstierende gelöste Stoffe enthalten. Ein weiterer wichtiger Unterschied zwischen isotonischen und isosmotischen Lösungen besteht darin, dass die isotonischen Lösungen unterschiedliche osmotische Drucke als die Zellen haben, die sie umgeben, während isosmotische Lösungen den gleichen osmotischen Druck wie die Zellen haben, die sie umgeben.
Isotonisch und isosmotisch sind Arten von Lösungen und Begriffe, denen wir häufig in Chemielabors begegnen. Viele bleiben verwirrt über den Unterschied zwischen den beiden Arten von Lösungen, die glauben, dass sie gleich sind. Sie sind jedoch nicht gleich und wir werden ihre Unterschiede in diesem Artikel hervorheben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Stoffe
3. Was ist isotonisch
4. Was ist isosmotisch
5. Seite an Seitenvergleich - isotonische vs isosmotische in tabellarischer Form
6. Zusammenfassung
Was sind Stoffe?
Gelöste Stoffe sind die Substanzen, die sich in einer Lösung auflösen. Um isosmotische und isotonische Lösungen zu verstehen, müssen wir erkennen, dass sie entweder durchdringende gelöste oder nicht penstierende gelöste Stoffe sind. Penetrierstoffe sind solche, die durch Membranen der Zelle gelangen können, die den osmotischen Druck über die Membran beeinflussen. Andererseits können nicht durchdringende gelöste Stoffe die Membran nicht durchlaufen, weshalb sie nur die Tonizität beeinflussen können.
Was ist isotonisch?
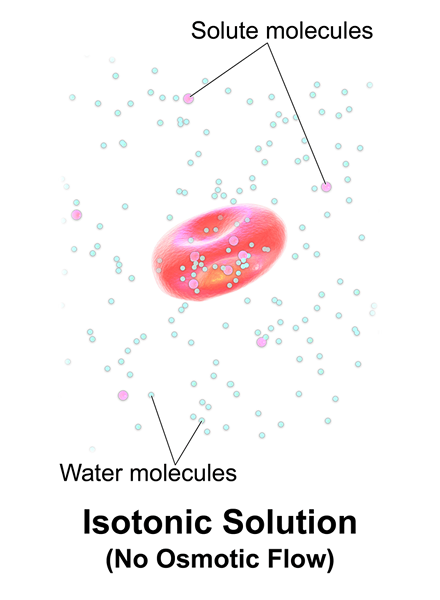
Isoton ist, wenn eine Lösung die gleiche Salzkonzentration wie Blut und Zellen des menschlichen Körpers hat. Isotonische Lösungen enthalten nur nicht durchdringende gelöste Stoffe und bezieht sich auf Lösungen mit dem gleichen osmotischen Druck wie die Zellen, die sie umgeben.

Abbildung 01: isotonische Lösung
Darüber hinaus nehmen sie nichts aus der Zelle ab und umgekehrt (Zellen nehmen auch keine gelösten Stoffe aus diesen Lösungen). Zum Beispiel ist eine Lösung mit 154 mmnaCl für Menschen isotonisch.
Was ist isosmotisch?
Isosmotik. Trotz der Tatsache, dass sie den gleichen osmotischen Druck wie die Zelle haben, umgeben sie. Sie enthalten durchdringende gelöste Stoffe, die in den osmotischen Druck der Zelle gelangen und erhöhen können. Wenn der osmotische Druck der Zelle zunimmt, wodurch die Zelle Wasser aus dem Medium absorbiert. Dies kann sich auf die Zelle auswirken, damit sie endlich platzen kann.
Saccharose ist beispielsweise eine Lösung, die keine Ionen hat. Eine Saccharose -Lösung, die 320 mm beträgt. Im Vergleich dieser Saccharose -Lösung mit einer 154 -mm -NaCl -Lösung zeigt es, dass sie 154 mmsodium (Na) und 154 mmchlorid (CL) oder etwa 308 Milliosmolar ist, was für Saccrose nahe 320 Milliosmolar ist.
Was ist der Unterschied zwischen isotonisch und isosmotisch?
Isotonisch bezieht sich auf eine Lösung, die die gleiche Konzentration gelöster Stoffkonzentration wie in einer Zelle oder einer Körperflüssigkeit hat. Isosmotic bezieht sich auf die Situation von zwei Lösungen mit dem gleichen osmotischen Druck. Daher enthalten isotonische Lösungen nur nicht durchdringende gelöste Stoffe, während isosmotische Lösungen sowohl durchdringende als auch nicht penstierende gelöste Stoffe enthalten.
Unter Berücksichtigung der Beziehung, die diese beiden Lösungstypen mit dem osmotischen Druck haben, haben isotonische Lösungen unterschiedliche osmotische Drücke als die Zellen, die sie umgeben. Im Gegenteil, isosmotische Lösungen haben den gleichen osmotischen Druck wie die Zellen, die sie umgeben. Darüber hinaus veranlassen isotonische Lösungen nicht, dass die Zellen Wasser aus der Umgebung absorbieren oder Wasser aus den Zellen verlieren. Isosmotische Lösungen veranlassen jedoch Zellen, Wasser aus der Umgebung zu absorbieren oder Wasser aus Zellen zu verlieren.
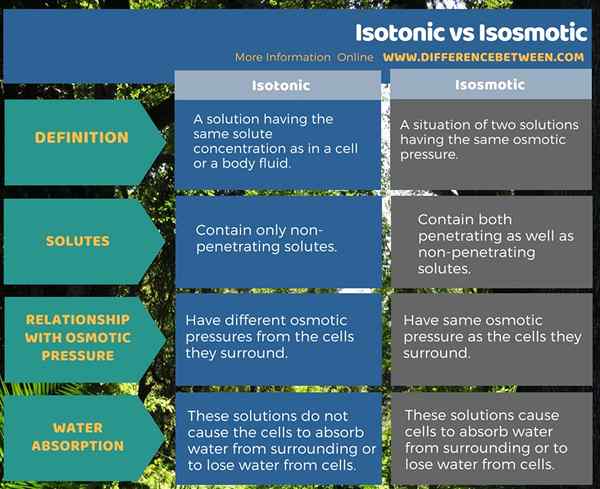
Zusammenfassung -isotonische vs isosmotische
Die Begriffe isotonisch und isosmotisch sind nützlich, um die Eigenschaften von Körperflüssigkeiten zu beschreiben. Beide Begriffe, isotonisch drückt die Idee aus, dass gleiche Konzentrationen gelöster gelösten Stoffe auftreten, während der Begriff isosmotisch die Idee ausdrückt, gleiche osmotische Drucke zu haben. Der Unterschied zwischen isotonisch und isosmotisch besteht darin, dass isotonische Lösungen nur nicht durchdringende gelöste Stoffe enthalten, während isosmotische Lösungen sowohl eindringliche als auch nicht penstierende gelöste Stoffe enthalten.
Referenz:
1. „Tonizität.”Wikipedia, Wikimedia Foundation, 8. Februar. 2018. Hier verfügbar
2. „Isosmotik.”Biologie online. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Blausen 0685 Osmoticflow Isotonic'By Blaussen.COM Staff (2014). "Medizingalerie von Blaussen Medical 2014". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.010. ISSN 2002-4436. - Eigene Arbeit (cc von 3.0) über Commons Wikimedia


