Unterschied zwischen Isotopen und Isobaren und Isotonen
Schlüsselunterschied - Isotope vs Isobars vs Isotone
Isotope sind Atome desselben chemischen Elements mit unterschiedlichen Anzahl von Neutronen. Daher haben Isotope desselben chemischen Elements die gleiche Atomzahl, aber unterschiedliche Atommassen. Isobar sind Atome verschiedener chemischer Elemente. Daher unterscheiden sich die Atomzahlen im Wesentlichen voneinander. Isotone haben die gleiche Anzahl von Neutronen in ihrem Atomkern. Der Schlüsselunterschied Zwischen Isotopen, Isobaren und Isotonen ist das Isotopen sind Atome mit der gleichen Anzahl von Protonen, aber unterschiedliche Anzahl von Neutronen und Isobars sind Atome verschiedener chemischer Elemente mit gleichen Werten für die Atommasse, während Isotone Atome verschiedener chemischer Elemente mit einer gleichen Anzahl von Neutronen im Atomkern sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Isotope?
3. Was sind Isobars?
4. Was sind Isotone?
5. Seite an Seitenvergleich - Isotopen gegen Isobars gegen Isotone in tabellarischer Form
6. Zusammenfassung
Was sind Isotope??
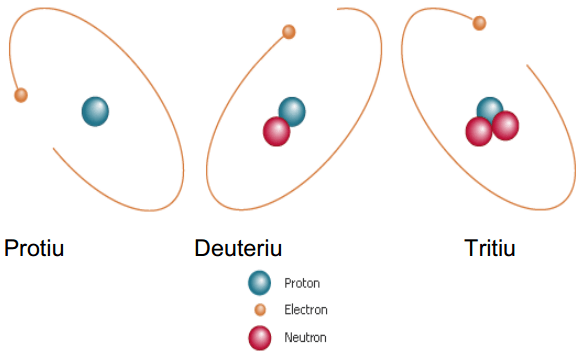
Isotope sind Atome mit der gleichen Anzahl von Protonen, aber unterschiedliche Anzahl von Neutronen. Eine Reihe von Protonen im Atom ist die Atomzahl dieses Atoms. Ein bestimmtes chemisches Element hat eine feste Anzahl von Protonen. Daher ähnelt die Atomzahl der Atome desselben chemischen Elements einander. Daher sind Isotope Atome des gleichen chemischen Elements. Die Gesamtzahl der Protonen und Neutronen ist als Atommasse bekannt. Isotope haben unterschiedliche Atommassen.
Das chemische Verhalten von Isotopen eines chemischen Elements ist identisch, aber die physikalischen Eigenschaften unterscheiden sich voneinander. Fast alle chemischen Elemente haben Isotope. Es gibt 275 bekannte Isotope von 81 stabilen chemischen Elementen. Für ein bestimmtes chemisches Element gibt es stabile Isotope sowie radioaktive Isotope (instabil).

Abbildung 01: Wasserstoffisotope
Ein Isotop wird mit dem Namen des chemischen Elements und der Atommasse des Isotops benannt. Zum Beispiel werden die beiden Helium-Isotope als „Helium-2“ und „Helium-4“ bezeichnet. Einige Beispiele für Isotope sind unten angegeben.

Was sind Isobars??
Isobar sind Atome verschiedener chemischer Elemente mit gleichen Werten für die Atommasse. Atommasse ist die Summe von Protonen und Neutronen im Kern eines Atoms. Ein Proton oder ein Neutron wird als a bekannt Nucleon. Daher haben Isobar die gleiche Anzahl von Nukleonen.
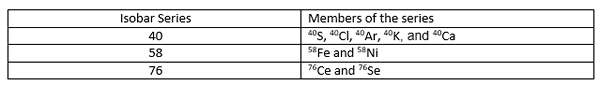
Die Atomzahl dieser Isobars unterscheidet sich voneinander, da verschiedene chemische Elemente unterschiedliche Atomzahlen aufweisen. In der Regel von Mattauch Isobar heißt es, dass, wenn zwei benachbarte Elemente in der Periodenzüchttabelle Isotope derselben Massenzahl (ISObar) haben, eines dieser Isotope radioaktiv sein muss. Wenn es Isobars mit drei sequentiellen Elementen gibt, sind erste und letzte Isobar stabil, und der mittlere kann radioaktiver Verfall unterzogen werden. Eine Isobar -Serie ist eine Sammlung verschiedener Isotope, die die gleiche Atommasse haben.
Was sind Isotone??
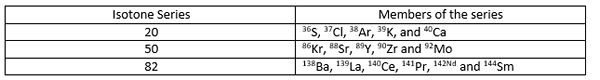
Isotone sind Atome von verschiedenen Elementen mit einer gleichen Anzahl von Neutronen im Atomkern mit. Isotone haben unterschiedliche Atomzahlen (die Anzahl der Protonen im Kern unterscheidet sich voneinander) sowie unterschiedliche Atommassen. Es kann wie unten ausgedrückt werden;
Atomzahl = z
Atommasse = a
Anzahl der Neutronen = n
Für alle Isotone in einer Serie ist A ≠ Z, aber (a-z) = n (n ist für alle Isotone in einer Serie gleich). Einige Beispiele für Isotone sind unten angegeben.
Was ist der Unterschied zwischen Isotopen und Isobaren und Isotonen?
Isotope gegen Isobars gegen Isotone | |
| Isotope | Isotope sind Atome mit der gleichen Anzahl von Protonen, aber unterschiedliche Anzahl von Neutronen. |
| Isobars | Isobar sind Atome verschiedener chemischer Elemente mit gleichen Werten für die Atommasse. |
| Isotone | Isotone sind Atome von verschiedenen Elementen mit einer gleichen Anzahl von Neutronen im Atomkern mit. |
| Ordnungszahl | |
| Isotope | Isotope haben die gleiche Atomzahl. |
| Isobars | Isobars haben unterschiedliche Atomzahlen. |
| Isotone | Isotone haben unterschiedliche Atomzahlen. |
| Atommasse | |
| Isotope | Isotope haben eine andere Atommasse. |
| Isobars | Isobar haben die gleiche Atommasse. |
| Isotone | Isotone haben unterschiedliche Atommasse. |
| Anzahl der Neutronen | |
| Isotope | Isotope haben unterschiedliche Anzahl von Neutronen. |
| Isobars | Isobars haben unterschiedliche Anzahl von Neutronen. |
| Isoton | Isotone die gleiche Anzahl von Neutronen. |
Zusammenfassung - Isotope vs Isobars vs Isotone
Isotope, Isobars und Isotone sind Begriffe, die zur Beschreibung von Beziehungen zwischen Atomen verschiedener chemischer Elemente verwendet werden. Der Unterschied zwischen Isotopen, Isobaren und Isotonen besteht darin, dass Isotope Atome mit der gleichen Anzahl von Protonen sind, jedoch unterschiedliche Anzahl von Neutronen und Isobars Atome von verschiedenen chemischen Elementen mit gleicher Werte für Atommasse sind, während Isotone Atome von unterschiedlichen Elementen mit gleicher Zahl sind von Neutronen im Atomkern.
Referenz:
1.Helmenstine, Anne Marie, D. „Definition und Beispiele in der Chemie Isotopes Definition und Beispiele in der Chemie.”Thoughtco, August. 4 2017. Hier verfügbar
2.Die Herausgeber von Encyclopædia Britannica. „Isotone.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20. Juli 1998. Hier verfügbar
3.„Isobar (Nuklid).”Wikipedia, Wikimedia Foundation, 27. Dezember. 2017. Hier verfügbar
4.Herzog, Gregory F. "Isotop.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 6. Dezember. 2017. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Izotopii hidrogenului'by nicolae coman - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia


