Unterschied zwischen Kinase und Phosphorylase
Schlüsselunterschied - Kinase gegen Phosphorylase
Sowohl Kinase als auch Phosphorylase sind Enzyme, die sich mit Phosphat befassen, obwohl es einen Unterschied in ihrer Funktion und Natur gibt. Der Hauptunterschied zwischen ihnen ist das, Kinase ist ein Enzym, das den Transfer einer Phosphatgruppe von ATP -Molekül zu einem bestimmten Molekül katalysiert, während Phosphorylase ein Enzym ist, das eine Phosphatgruppe in ein organisches Molekül einführt, insbesondere Glukose, insbesondere Glukose. In diesem Artikel werden Sie Kinase- und Phosphorylase -Enzyme vorgestellt, die sich mit Phosphat befassen und erklären, welche Unterschiede zwischen Kinase und Phosphorylase sind.
Was ist Phosphorylase?
Phosphorylas wurden von Earl W entdeckt. Sutherland Jr. Ende der 1930er Jahre. Diese Enzyme katalysieren die Zugabe einer Phosphatgruppe von einem anorganischen Phosphat oder Phosphat+Wasserstoff zu einem organischen Molekülakzeptor. Als Beispiel kann Glykogenphosphorylase die Synthese von Glucose-1-phosphat aus einem Glucan einschließlich eines Glykogen-, Stärke- oder Maltodextrinmoleküls katalysieren. Die Reaktion ist als Phosphorolyse bekannt, die auch einer Hydrolyse ähnelt. Die einzige Unähnlichkeit ist jedoch, dass es sich um ein Phosphat handelt, kein Wassermolekül, das auf die Bindung gelegt wird.
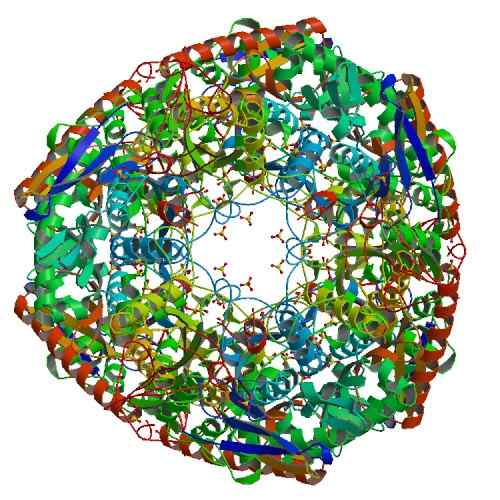
Struktur der Polynukleotidphosphorylase
Was ist Kinase?
Kinase-Enzym kann den Transfer von Phosphatgruppen von hochenergetischen, phosphat-donendierenden Molekülen zu bestimmten Substraten katalysieren können. Dieser Prozess wird als Phosphorylierung identifiziert, wenn das Substrat eine Phosphatgruppe erhält und das hohe Energiemolekül von ATP eine Phosphatgruppe spendet. In diesem Phosphorylierungsprozess spielen Kinasen eine bedeutende Rolle und ist Teil der größeren Familie von Phosphotransferasen. Daher sind Kinasen für den Zellstoffwechsel, die Proteinregulation, den Zelltransport und zahlreiche Zellwege sehr wichtig.

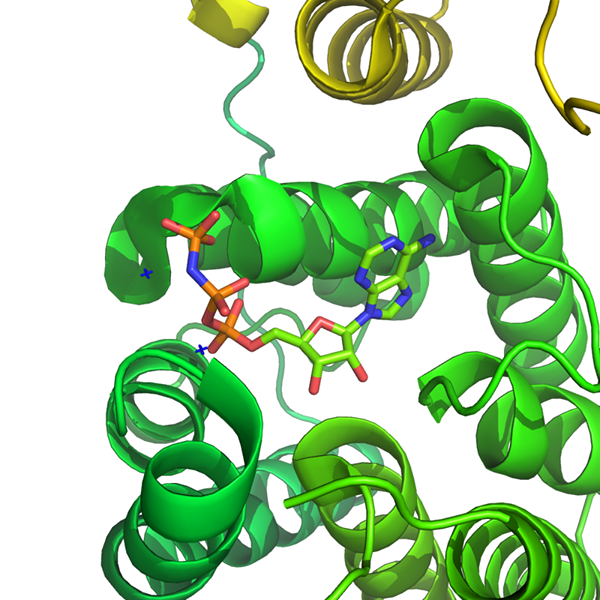
Dihydroxyacetonkinase im Komplex mit einem nicht hydrolysierbaren ATP-Analogon
Was sind die Unterschiede zwischen Kinase und Phosphorylase?
Definition von Kinase und Phosphorylase
Kinase: Kinase ist ein Enzym.
Phosphorylase: Phosphorylase ist ein Enzym, das die Zugabe einer Phosphatgruppe von einem anorganisch.
Eigenschaften von Kinase und Phosphorylase
Wirkmechanismus
Kinase: Katalysieren Sie die Übertragung einer terminalen Phosphatgruppe von ATP auf eine -OH -Gruppe auf einem Substrat. Dadurch eine Phosphatesterbindung im Produkt produzieren. Die Reaktion ist bekannt als Phosphorylierung, und die Gesamtreaktion ist geschrieben als,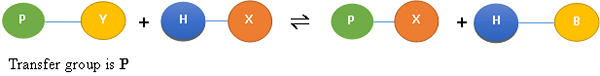
Phosphorylase: Katalysieren Sie die Einführung einer Phosphatgruppe in ein organisches Molekül. Die Reaktion ist als a bekannt Phosphoryse und die Gesamtreaktion ist geschrieben als,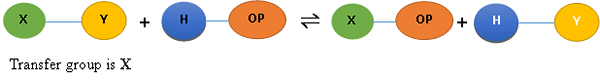
Phosphatspender bei der Reaktion von Kinase- und Phosphorylase -Enzymen
Kinase: Phosphatgruppe aus ATP -Molekül
Phosphorylase: Phosphatgruppe aus anorganischem Phosphat
Kinase- und Phosphorylase -Enzyme
Kinase: Spezifische organische Moleküle wie Kohlenhydrate, Protein oder Lipid
Phosphorylase: Organisches Molekül hauptsächlich Glukose
Endprodukte von Kinase- und Phosphorylase -Enzymen
Kinase: ADP (Energiemolekül) + phosphoryliertes Substrat
Phosphorylase: Wenn das Substrat Glukose ist, kann es Glukose-1-phosphat produzieren
Kinase- und Phosphorylase -Enzyme
Kinase: Kinase ist ein sehr komplexes Protein der Tertiärstruktur.
Phosphorylase: Die biologisch aktive Form der Phosphorylase ist ein Dimer von zwei gleichen Protein -Subeinheiten. Zum Beispiel ist Glykogenphosphorylase ein riesiges Protein, das mit 842 Aminosäuren und Masse von 97 enthalten ist.434 kda. Das Glykogenphosphorylase -Dimer weist mehrere Abschnitte von biologischer Bedeutung auf, einschließlich katalytischer Stellen, Glykogenbindungsstellen sowie allosterischen Stellen.
Regulation des Kinase- und Phosphorylase -Enzyms
Kinase: Die Aktivität der Kinasen ist stark reguliert und sie haben intensive Auswirkungen auf eine Zelle. Kinasen werden durch Phosphorylierung, durch Bindung des Proteinaktivators oder eines Proteininhibitors oder durch die Registrierung ihrer Position in der Zelle in Bezug auf ihre Substrate ein- oder ausgeschaltet.
Phosphorylase: Die Glykogenphosphorylase wird sowohl durch allosterische Kontrolle als auch durch Phosphorylierung reguliert. Hormone wie Epinephrin und Insulin können auch die Glykogenphosphorylase regulieren.
Klassifizierung von Kinase- und Phosphorylase -Enzymen
Kinase: Kinasen werden nach dem Substrat, auf das sie wirken, wie Proteinkinasen, Lipidkinasen und Kohlenhydratkinasen in umfassende Gruppen eingeteilt.
Phosphorylase: Die in zwei kategorisierten Phosphorylas; Glycosyltransferasen und Nukleotidyltransferasen. Beispiele für Glycosyltransferasen sind,
- Glykogenphosphorylase
- Stärkephosphorylase
- Maltodextrin -Phosphorylase
- Purin -Nukleosidphosphorylase
Beispiel für Nucleotidyltransferasen ist,
- Polynukleotidphosphorylase
Pathologie der Kinase- und Phosphorylase -Enzyme
Kinase: Die dekontrollierte Kinaseaktivität kann beim Menschen Krebs und Krankheiten verursachen, einschließlich bestimmter Arten von Leukämie und vielen anderen, da Kinasen viele Phasen regulieren, die den Zellzyklus wie Wachstum, Bewegung und Tod kontrollieren.
Phosphorylase: Einige medienkalische Erkrankungen wie Glykogenspeichererkrankungen Typ V - Muskelglykogen und Glykogenspeichererkrankung Typ VI - Leberglykogen usw. sind mit Phosphorylas assoziiert.
Referenzen Chang. S., Rosenberg, m.J., Morton, h., Francomano, c.A. und Biesecker, l.G. (1998). Identifizierung einer Mutation in Leberglykogenphosphorylase in der Glykogenspeichererkrankung Typ VI. Summen. Mol. Genet., 7(5): 865-70. Ciesla, j., Frączyk, t. und ritten, w. (2011). Phosphorylierung basisches Aminosäurereste in Proteinen: Wichtig, aber leicht zu übersehen. Acta Biochimica Polonica, 58(2): 137-147. Hunter, t. (1991). Proteinkinase -Klassifizierung. Methoden in der Enzymologie, 200: 3-37. Johnson, l. N. (2009). Die Regulation der Proteinphosphorylierung. Biocheme Soc. Trans., 37(2): 627-641. Johnson, l. N. und Barford, D. (1993). Die Auswirkungen der Phosphorylierung auf die Struktur und Funktion von Proteinen. Jährliche Überprüfung der Biophysik und Biomolekularstruktur, 22(1): 199-232. Manning, g. und Whyte, D. B. (2002). Die Proteinkinase -Komplement des menschlichen Genoms. Wissenschaft, 298(5600): 1912-1934. Bild mit freundlicher Genehmigung: „aktives Zentrum der Dihydroxyaceton -Kinase“ von BDOC13 - eigene Arbeit. (CC BY-SA 3.0) über Wikimedia Commons „Kristallstruktur 1e3p“. (Public Domain) über Wikimedia Commons

