Unterschied zwischen KSP und QSP
Schlüsselunterschied - KSP vs QSP
KSP ist die Löslichkeitsproduktkonstante und QSP ist der Löslichkeitsproduktquotient. Der Schlüsselunterschied Zwischen KSP und QSP ist das KSP gibt die Löslichkeit einer Substanz an, während QSP den aktuellen Zustand einer Lösung angibt. Das Löslichkeitsprodukt ist das Produkt von Konzentrationen von Ionenspezies, die in einer Lösung vorhanden sind, wenn eine Substanz in einem Lösungsmittel wie Wasser gelöst wird.
Das Löslichkeitsprodukt wird bestimmt, wenn die Lösung mit dieser Substanz gesättigt ist. Löslichkeitsproduktquotient ist das Produkt der Konzentrationen von ionischen Arten in einer Lösung jederzeit; vor der Sättigung oder nach der Lösung gesättigt ist. Es ist manchmal als ionisches Produkt bekannt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist KSP
3. Was ist QSP
4. Beziehung zwischen KSP und QSP
5. Seite an Seite Vergleich - KSP vs QSP in tabellarischer Form
6. Zusammenfassung
Was ist KSP?
KSP ist die Löslichkeitsproduktkonstante einer bestimmten Substanz. Es zeigt die Löslichkeit einer Substanz an (wie viel Feststoff in einer Lösung gelöst ist). Die Löslichkeitsproduktkonstante wird für eine Lösung angegeben, die mit einer Substanz gesättigt ist. Höher der KSP, höher die Löslichkeit dieser Substanz. Das Löslichkeitsprodukt wird als Produkt von Konzentrationen ionischer Arten in einer Lösung angegeben.
Eine gesättigte Lösung erscheint mit Trübung, die den Beginn der Bildung eines Niederschlags anzeigt. Es ist die unlösliche Form des gelösten Stoffes. Der flüssige Teil dieses Systems hat die löslichen gelösten Stoffe. Der KSP dieser Lösung repräsentiert das Gleichgewicht zwischen diesen löslichen und unlöslichen Formen.
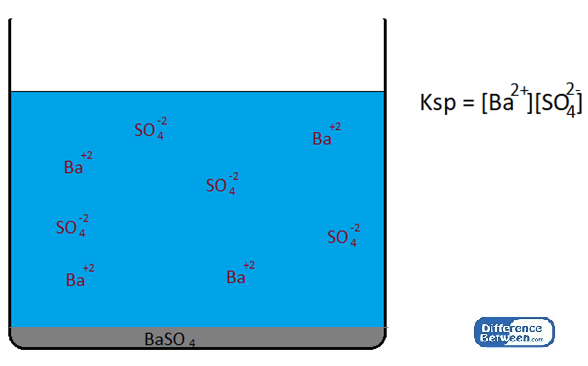
Die Faktoren, die den Wert der Löslichkeitsproduktkonstante beeinflussen, sind die Temperatur, das Vorhandensein von gemeinsamen Ionen, den pH -Wert oder die Säure usw. Wenn die Temperatur erhöht wird, nimmt auch die Löslichkeit des festen Niederschlags zu. Dann nimmt das Produkt der Konzentrationen ionischer Arten zu, was zu einem hohen Wert der Löslichkeitsproduktkonstante führt. Das Vorhandensein eines gemeinsamen Ions wird durch den gemeinsamen Ioneneffekt beschrieben. Wenn ein gemeinsames Ion vorhanden ist, wird der KSP verringert. Ein gemeinsames Ion bedeutet eine der ionischen Arten, die bereits in dieser Lösung vorhanden sind. Zum Beispiel für ein Gleichgewichtssystem, das Baso4 (Bariumsulfat) enthält, fällt zusammen mit, BA+2 Ionen und so42- Ionen, die Zugabe von beiden BA+2 oder so42- Ionen können das Gleichgewicht beeinflussen.
Baso4 (s)↔ ba+2(aq) + SO42-(aq)

Abbildung 01: KSP einer Baso4 -gesättigten Lösung
Wenn einer dieser Ionen von einer externen Quelle hinzugefügt wird, verschiebt sich das obige Gleichgewicht zur linken Seite (eine unlösliche Form der Substanz wird gebildet, was die Menge der in der Lösung vorhandenen Ionen verringert), wodurch die Löslichkeit dieser Substanz verringert wird.
Was ist QSP?
QSP ist der Löslichkeitsproduktquotient einer Lösung. Es beschreibt den aktuellen Zustand einer Lösung. Dies bedeutet. Der QSP wird auch als Ionenprodukt bezeichnet, da es zu jedem Zeitpunkt das Produkt von Konzentrationen ionischer Arten ist (nicht in einem bestimmten Moment wie Sättigung). Daher ist KSP (die Löslichkeitsproduktkonstante) eine spezielle Form von QSP.
Wie ist die Beziehung zwischen KSP und QSP?
- Wenn der QSP -Wert für eine Substanz in einer Lösung geringer als der KSP ist, können in dieser Lösung mehr Feststoffe gelöst werden.
- Wenn QSP und KSP gleiche Werte haben, ist die Lösung gesättigt geworden.
- Wenn der QSP höher ist als der Wert von KSP, wird ein Niederschlag gebildet.
Was ist der Unterschied zwischen KSP und QSP?
KSP gegen QSP | |
| KSP ist die Löslichkeitsproduktkonstante einer bestimmten Substanz. | QSP ist der Löslichkeitsproduktquotient einer Lösung. |
| Natur | |
| KSP ist ein Gleichgewichtswert. | QSP ist kein Gleichgewichtswert. |
| Zustand der Lösung | |
| KSP ist das Produkt der Konzentrationen von ionischen Spezies in einer gesättigten Lösung. | QSP ist das Produkt der Konzentrationen von ionischen Spezies in einer ungesättigten, gesättigten oder übersättigten Lösung. |
Zusammenfassung - KSP vs QSP
KSP und QSP sind sehr verwandte Begriffe in der Chemie. KSP ist definiert als eine gesättigte Lösung, die ein Gleichgewicht zwischen ionischen Spezies und einem festen Niederschlag aufweist (das Moment, in dem die Bildung eines Niederschlags begonnen hat). QSP wird für jeden Moment angegeben (nicht angegeben); vor der Sättigung oder nach der Sättigung. Der Unterschied zwischen KSP und QSP besteht darin, dass KSP die Löslichkeitsproduktkonstante ist, während QSP der Löslichkeitsproduktquotient ist.


