Unterschied zwischen Bleichlorid und Silberchlorid

Der Schlüsselunterschied Zwischen Bleichlorid und Silberchlorid ist das Bleichlorid ist sparsam löslich in kaltem Wasser, aber in heißem Wasser löslich, während Silberchlorid in Wasser unlöslich ist.
Bleichlorid und Silberchlorid sind anorganische Verbindungen, die für ihre Unlöslichkeit im Wasser bekannt sind. Mercuric Chlorid ist die andere feste Verbindung, die unter die gleiche Kategorie fällt. In heißem Wasser ist jedoch nur Bleichlorid unter diesen drei Verbindungen löslich.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Bleichlorid
3. Was ist Silberchlorid
4. Nebeneinander Vergleich - Bleichlorid gegen Silberchlorid in tabellarischer Form
5. Zusammenfassung
Was ist Bleichlorid
Bleichlorid oder Blei (II) Chlorid ist eine anorganische Verbindung, die unter Umgebungsbedingungen als weißer Feststoff auftritt. Diese Verbindung ist schlecht wasserlöslich, löst sich aber in heißem Wasser auf. Es ist ein wichtiges Lead-basiertes Reagenz. Wir können diese Verbindung in Form des Mineral -Cotunnits auf natürliche Weise finden.

Abbildung 01: Bleichlorid
Die feste Form von Bleichlorid hat jeweils von neun Chloridionen in Form einer dreieckigen dreieckigen Prismenbildung koordiniert. Gasphasenblei-Chloridmoleküle haben eine gebogene Geometrie. Diese Verbindung tritt natürlich auf und kann eine weiße, farblose, gelbe oder grüne Farbe haben.
Es gibt verschiedene Methoden zur Synthese von Bleichlorid, wie die Doppelverschiebungsmethode, direkte Reduktion und direkte Chlorierung. In der doppelten Verschiebungsmethode schlägt Blei (ii) Chlorid aus.
Bei der Betrachtung der Verwendung von Bleichloridverbindung ist das geschmolzene Bleichlorid nützlich bei der Synthese von Bleinitrat- und Barium -Blei -Titanat -Keramik über Kationenersatzreaktionen, nützlich bei der Erzeugung von Infrarot -Übertragungsglas, nützlich im HCL -Service usw. nützlich.
Was ist Silberchlorid?
Silberchlorid ist Agcl. Es ist eine anorganische Verbindung, die als weißer kristalline Feststoff erscheint. Diese Verbindung ist bekannt für ihre Unlöslichkeit im Wasser. Dieser Feststoff ist jedoch in Ammoniak, konzentriertes HCl, konzentriertes H2SO4, Alkali -Cyanid usw. löslich.

Abbildung 02: Silberchloridverbindung
Bei der Betrachtung der Herstellung von Silberchlorid können wir diese Verbindung leicht synthetisieren, indem wir wässrige Lösungen von Silbernitrat und Natriumchlorid kombinieren. Außerdem können wir es über die Reaktion zwischen Kobalt (II) Chlorid und Silbernitrat produzieren.
Es gibt verschiedene wichtige Verwendungen von Silberchlorid, einschließlich der Verwendung von Silberchloridelektrode in der Elektrochemie, die in Keramikglasuren für die Herstellung von Ingleaze -Glanz als Gegenmittel für die Quecksilbervergiftung nützlich ist, um fotografisches Papier zu erstellen, das für Photochromlinsen, In -Bandagen und Wund nützlich ist Heilungsprodukte als antimikrobielles Mittel usw.
Was ist der Unterschied zwischen Bleichlorid und Silberchlorid?
Bleichlorid, Silberchlorid und Mercuric Chlorid sind in Wasser sehr unlöslich. Der Hauptunterschied zwischen Bleichlorid und Silberchlorid besteht darin, dass das Bleichlorid in kaltem Wasser sparsam löslich ist, aber in heißem Wasser löslich ist, während das Silberchlorid selbst in heißem Wasser unlöslich ist. Darüber hinaus ist Bleichlorid oder Blei (II) Chlorid PBCL2, während Silberchlorid AgCL ist.
Die folgende Infografik fasst die Unterschiede zwischen Bleichlorid und Silberchlorid in tabellarischer Form zusammen.
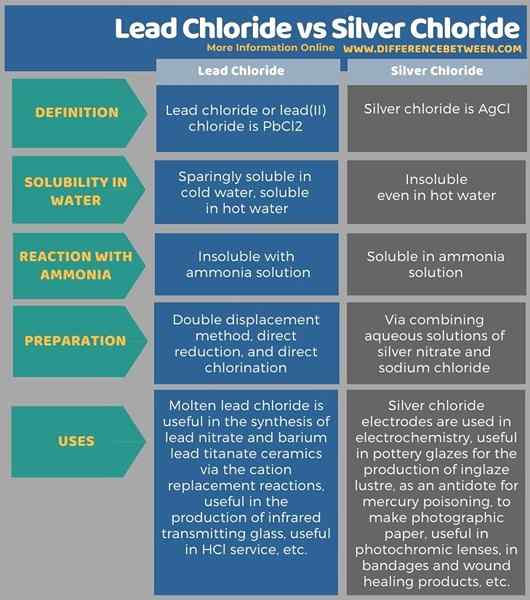
Zusammenfassung -Bleichlorid gegen Silberchlorid
Kurz gesagt, das Bleichlorid und Silberchlorid sind anorganische Verbindungen. Der wichtigste Unterschied zwischen Bleichlorid und Silberchlorid besteht jedoch darin, dass das Bleichlorid in kaltem Wasser sparsam löslich ist, aber in heißem Wasser löslich ist, während das Silberchlorid in Wasser unlöslich ist. Darüber hinaus kann Silberchlorid mit Ammoniaklösung reagieren. Daher können wir problemlos qualitative Methoden verwenden, um zwischen Bleichlorid und Silberchlorid zu unterscheiden.
Referenz:
1. „Blei Chlorid.Pubchem. Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "PBCL2Precipiat" von Rrausch1974 - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "Chlorid Stříbrný" von Ondřej Manggl - eigener Arbeit (öffentliches Domäne) über Commons Wikimedia


