Unterschied zwischen Lewis Dot -Symbol und Lewis -Struktur
Der Schlüsselunterschied Zwischen Lewis Dot -Symbol und Lewis -Struktur ist das Lewis DOT.
Lewis -Struktur ist eine einfache Struktur, die die chemischen Bindungen und einsamen Elektronenpaare in einfachen Molekülen darstellt. Das Lewis -Punkt -Symbol repräsentiert ein Elektron; Daher müssen wir zwei Punkte verwenden, um eine chemische Bindung darzustellen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Lewis Dot -Symbol
3. Was ist Lewis -Struktur
4. Seite an Seite Vergleich -Lewis Dot -Symbol gegen Lewis -Struktur in tabellarischer Form
5. Zusammenfassung
Was ist Lewis Dot -Symbol?
Lewis Dot -Symbol repräsentiert ein einzelnes Elektron. Wenn wir daher eine chemische Bindung in einem Molekül zeigen müssen, müssen wir zwei Elektronen als Paar verwenden. Darüber hinaus müssen wir ein Paar Punkte verwenden, um ein einsames Elektronenpaar zu zeigen. Die Punktsymbole werden um das Symbol des chemischen Elements platziert, zu dem das bestimmte Atom gehört. Zum Beispiel können wir das Elektron des Wasserstoffatoms wie folgt geben:

Abbildung 01: Elektron des Wasserstoffatoms
Was ist Lewis -Struktur?
Die Lewis -Struktur ist eine Darstellung einfacher Moleküle mit Punktsymbolen. Diese Punktsymbole repräsentieren die Elektronen des äußersten Orbitals von Atomen im Molekül. Beim Zeichnen einer Lewis -Struktur müssen wir zunächst die Anzahl der Valenzelektronen aller Atome im Molekül ermitteln. Dann müssen wir die Anzahl der Elektronen finden, die die äußere Elektronenhülle nach der Oktettregel auffüllen. Danach müssen wir die Anzahl der im Molekül vorhandenen chemischen Bindungen bestimmen, und wir müssen auch herausfinden, ob sie sich in einzelnen Bindungen, Doppelbindungen und Dreifachbindungen befinden.
Darüber hinaus müssen wir je nach Elektronegativität der Atome ein zentrales Atom für das Molekül bestimmen. Hier wird das Atom mit der geringsten Elektronegativität als zentrales Atom angesehen. Dann können wir eine Skelettstruktur für dieses Molekül zeichnen. Für diese Skelettdarstellung können wir die Symbole der chemischen Elemente und Punktsymbole verwenden. Wir müssen zwei Punkte verwenden, wenn wir eine chemische Bindung darstellen, und nach dem Platzieren der Elektronenpaare für die Bindungen können die verbleibenden Elektronen als einzige Elektronenpaare dargestellt werden.
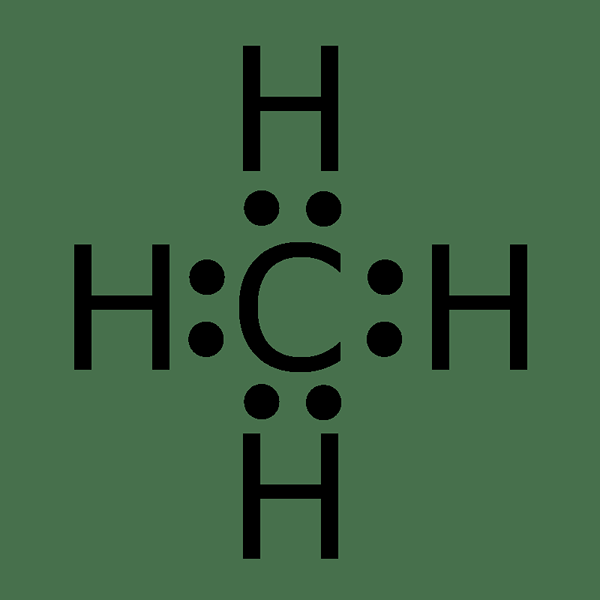
Betrachten wir ein Beispiel, um die Methodik des Zeichnens einer Lewis -Struktur zu verstehen. Die Schritte zum Zeichnen der Lewis -Struktur für das Methanmolekül sind wie folgt:

Abbildung 02: Lewis -Struktur des Methanmoleküls
- Die chemische Formel von Methan ist CH4.
- Das Kohlenstoffatom ist weniger elektronegativ als das Wasserstoffatom. Daher ist das zentrale Atom des Moleküls Kohlenstoff.
- Es hat vier Elektronen in der äußersten Elektronenschale.
- Es gibt vier Wasserstoffatome um das zentrale Kohlenstoffatom. Vier Wasserstoffatome benötigen vier Elektronen aus Kohlenstoffatom, um einzelne chemische Bindungen zu bilden. Daher sind alle vier Valenzelektronen von Kohlenstoffatomen an der Bindung beteiligt, und in diesem Molekül gibt es keine einzelnen Elektronenpaare um das Kohlenstoffatom.
Was ist der Unterschied zwischen Lewis Dot -Symbol und Lewis -Struktur?
Die Lewis -Struktur ist eine einfache Struktur, die die chemischen Bindungen und die einsamen Elektronenpaare in einfachen Molekülen darstellt. Der Schlüsselunterschied zwischen Lewis -Punktsymbol und Lewis -Struktur besteht darin, dass das Lewis -Punkt -Symbol Elektronen in der äußersten Elektronenschale eines Atoms in einem Molekül darstellt, während eine Lewis -Struktur die Struktur von Molekülen darstellt.
Im Folgenden finden Sie einen Vergleich des Unterschieds zwischen Lewis Dot -Symbol und Lewis -Struktur.
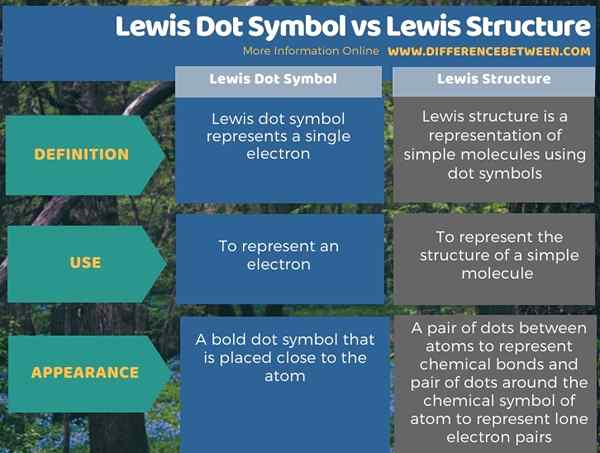
Zusammenfassung -Lewis Dot -Symbol gegen Lewis -Struktur
Die Lewis -Struktur ist eine einfache Struktur, die die chemischen Bindungen und die einsamen Elektronenpaare in einfachen Molekülen darstellt. Der Hauptunterschied zwischen Lewis -Punktsymbol und Lewis -Struktur besteht darin, dass das Lewis -Punkt -Symbol Elektronen in der äußersten Elektronenschale eines Atoms in einem Molekül darstellt. In der Zwischenzeit repräsentiert eine Lewis -Struktur die Struktur von Molekülen unter Verwendung von Symbolen für chemische Elemente und Punktsymbole
Referenz:
1. Helmenstine, Todd. „Wie man eine Lewis -Struktur zeichnet.”Thoughtco, Sep. 6, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Wasserstoff Lewis" von Ricordisamoa - eigene Arbeit, Vektorversion der Datei: Wasserstoff Lewis.PNG (Public Domain) über Commons Wikimedia
2. "Elektronenformel Punkte CH4" von Apostoloff - eigene Arbeit (Public Domain) über Commons Wikimedia


