Unterschied zwischen lokalisierten und delokalisierten chemischen Bindungen
Der Schlüsselunterschied Zwischen lokalisierten und delokalisierten chemischen Bindungen ist Diese lokalisierte chemische Bindung ist eine spezifische Bindung oder ein einsames Elektronenpaar auf einem bestimmten Atom, während delokalisierte chemische Bindung eine spezifische Bindung ist.
Eine chemische Bindung ist eine Verbindung zwischen zwei Atomen. Diese Verbindung tritt aufgrund der Überlappung molekularer Orbitale auf. Es gibt zwei Hauptformen von Bindungen als lokalisierte und delokalisierte chemische Bindungen. Lokalisierte chemische Bindungen sind die normalen molekularen Orbitalüberlagerungen wie Sigma -Bindungen und PI -Bindungen. Delokalisierte chemische Bindungen sind jedoch unterschiedlich. Diese Bindungen bilden sich, wenn sich mehrere lokalisierte Bindungen miteinander vermischen. Weitere Details finden Sie unten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind lokalisierte chemische Bindungen
3. Was sind delokalisierte chemische Bindungen
4. Nebenseitiger Vergleich - lokalisierte gegen delokale chemische Bindungen in tabellarischer Form
5. Zusammenfassung
Was sind lokalisierte chemische Bindungen?
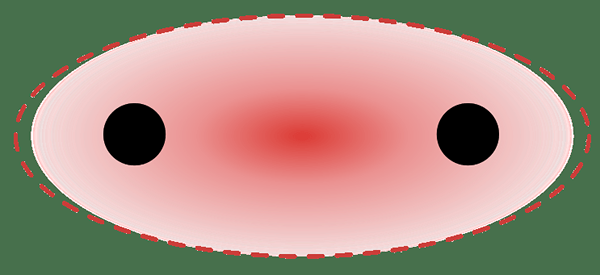
Lokalisierte chemische Bindungen sind normale Sigma- und PI -Bindungen oder einsame Elektronenpaare, die auf einem einzelnen Atom existieren. Diese Bindungen konzentrieren sich auf eine begrenzte Region eines Moleküls. Diese Regionen haben eine konzentrierte Elektronenverteilung. Mit anderen Worten, die Elektronendichte dieser Region ist sehr hoch.

Abbildung 01: Eine Sigma -Bindung - eine lokalisierte chemische Bindung
Eine lokalisierte Bindung bildet sich, wenn sich zwei molekulare Orbitale von zwei getrennten Atomen miteinander überlappen. Sigma-Anleihen können sich aufgrund der Überlappung von zwei S-Orbitalen bilden, zwei P-Orbitalen oder S-P-Überlappungen.
Was sind delokalisierte chemische Bindungen?
Delokalisierte chemische Bindungen sind die chemischen Bindungen, die nicht nur mit einem einzigen Atom, sondern mit mehreren Atomen oder anderen chemischen Bindungen assoziieren. Wir nennen die Elektronen in diesen Anleihen als "delokalisierte Elektronen". Die Delokalisierung tritt im konjugierten PI -System auf. Ein konjugiertes PI -System verfügt über doppelte Bindungen und einzelne Bindungen in einem alternierenden Muster.
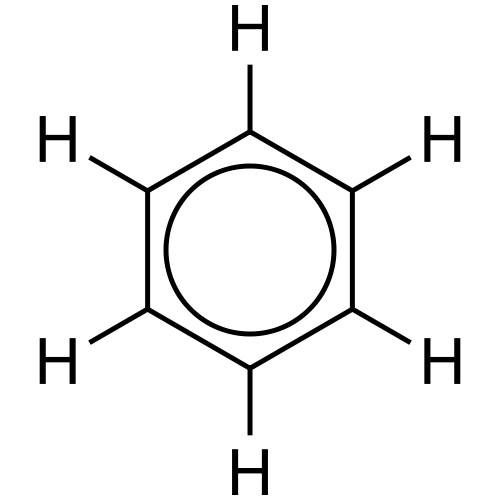
Abbildung 02: Delokalisierung von Elektronen
Zum Beispiel hat der Benzolring drei einzelne Bindungen und drei Doppelbindungen in einem abwechselnden Muster. Jedes Kohlenstoffatom in diesem Ring hat ein P -Orbital, das keine frontale Überlappung unterzogen wird. Daher können diese P -Orbitale eine Seitenüberlappung haben. Diese Art von Überlappung ist die Delokalisierung. Wir können dies als zwei Kreise auf der Oberseite des Benzolrings und am Boden des Rings angeben. Diese Elektronen können sich im gesamten Molekül bewegen, da sie keine dauerhafte Bindung an ein einzelnes Atom oder eine kovalente Bindung haben.
Was ist der Unterschied zwischen lokalisierten und delokalisierten chemischen Bindungen?
Lokalisierte chemische Bindungen sind normale Sigma- und PI -Bindungen oder einsame Elektronenpaare, die auf einem einzelnen Atom vorhanden sind. Diese Anleihen bilden sich aufgrund der frontalen Überlappung zwischen S -Orbitalen, P -Orbitalen oder S- und P -Orbitalen. Darüber hinaus sind diese Elektronen auf einen bestimmten Bereich zwischen zwei getrennten Atomen beschränkt. Delokalisierte chemische Bindungen sind die chemischen Bindungen, die nicht nur mit einem einzigen Atom, sondern mit mehreren Atomen oder anderen chemischen Bindungen assoziieren. Diese Bindungen haben Elektronen im gesamten Molekül ausgebreitet, die sich frei bewegen können. Diese Bindungen bilden sich aufgrund der Seitenüberlappung von P -Orbitalen. Dies ist der Hauptunterschied zwischen lokalisierten und delokalisierten chemischen Bindungen.
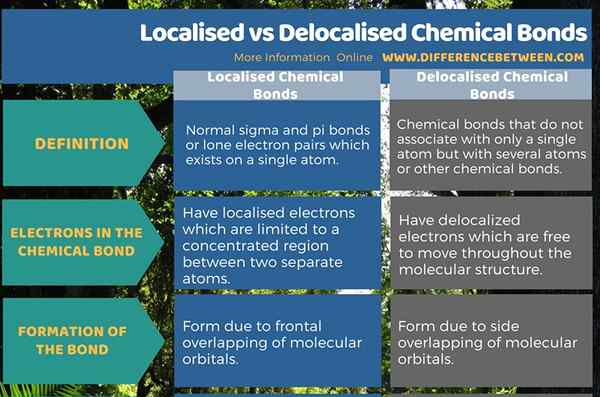
Zusammenfassung -lokalisierte gegen delokalisierte chemische Bindungen
Eine chemische Bindung ist eine Verbindung zwischen zwei Atomen. Es gibt zwei Formen chemischer Bindungen als lokalisierte und delokalisierte chemische Bindungen. Der Unterschied zwischen lokalisierten und delokalisierten chemischen Bindungen besteht darin, dass eine lokalisierte chemische Bindung eine spezifische Bindung oder ein einziges Elektronenpaar auf einem bestimmten Atom ist, während eine delokalisierte chemische Bindung eine spezifische Bindung ist, die nicht mit einem einzelnen Atom oder einer kovalenten Bindung assoziiert ist.
Referenz:
1. Libretexten. „Delokalisierung von Elektronen.”Chemistry Libretexten, Libretexte, 20. Dezember. 2016. Hier verfügbar
2. „Lokalisierte molekulare Orbitale.Wikipedia, Wikimedia Foundation, 19. Juni 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Sigma Bond'by Svg: Zoofari; Raster: Anselm H. C. Horn (CC BY-SA 3.0) über Commons Wikimedia
2.'Benzol-6H-Delokalisierung' von einer Elite-eigene Arbeit, (CC BY-SA 3.0) über Commons Wikimedia


