Unterschied zwischen lokalisierten und delokalisierten Elektronen
Der Schlüsselunterschied Zwischen lokalisierten und delokalisierten Elektronen ist das Lokalisierte Elektronen befinden sich zwischen Atomen, während sich delokalisierte Elektronen über und unter Atomen befinden.
In der allgemeinen Chemie sind lokalisierte Elektronen und delokalisierte Elektronen Begriffe, die chemische Strukturen chemischer Verbindungen beschreiben. Lokalisierte Elektronen sind die Bindungselektronen in Molekülen, während delokalisierte Elektronen nichtbindende Elektronen sind, die als Elektronenwolken über und unter dem Molekül auftreten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind lokalisierte Elektronen
3. Was sind delokalisierte Elektronen
4. Nebenseitiger Vergleich - lokalisierte vs delokalisierte Elektronen in tabellarischer Form
5. Zusammenfassung
Was sind lokalisierte Elektronen?
Lokalisierte Elektronen sind die Bindungselektronen in chemischen Verbindungen. Diese Elektronen befinden sich zwischen Atomen, bei denen Sigma -Bindungen gefunden werden können. Sigma-Bindungen sind die Bindungen, die durch die axiale Überlappung von halb gefüllten Atomorbitalen von Atomen gebildet werden.
Daher treten lokalisierte Elektronen in kovalenten Verbindungen mit kovalenten chemischen Bindungen auf. Diese lokalisierten Elektronen gehören zu zwei bestimmten Atomen, im Gegensatz zu delokalisierten Elektronen, die allen Atomen im Molekül gemeinsam sind. Lokalisierte Elektronen werden zwischen Atomen geteilt, die kovalente Bindungen, Koordinationsbindungen usw. bilden.
Was sind delokalisierte Elektronen?
Delokalisierte Elektronen sind die nicht gebundenen Elektronen in chemischen Verbindungen. Dieser Begriff bezieht sich auf Elektronen, die nicht mit einem einzelnen Atom oder einer kovalenten Bindung verbunden sind. Der Begriff delokalisierter Elektron hat jedoch unterschiedliche Bedeutungen in verschiedenen Feldern. Zum Beispiel sind in der organischen Chemie delokalisierte Elektronen in den Resonanzstrukturen konjugierter Systeme in aromatischen Verbindungen enthalten. In der Festkörperphysik sind delokalisierte Elektronen die freien Elektronen, die die elektrische Leitung erleichtern. Darüber hinaus verwenden die Quantenphysik den Begriff delokalisierte Elektronen, um sich auf molekulare Orbitalelektronen zu beziehen, die sich über mehrere Atome verlängert haben.

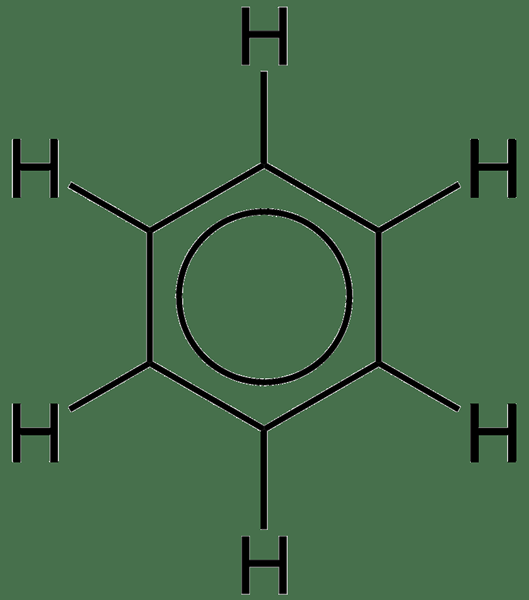
Abbildung 01: Benzol (Delokalisierung der Elektronen wird durch den Kreis angezeigt)
Der Benzolring ist das einfachste Beispiel für ein aromatisches System mit delokalisierten Elektronen. Es gibt sechs PI -Elektronen im Benzolmolekül; Wir geben diese häufig mit einem Kreis grafisch an. Dieser Kreis bedeutet, dass die PI -Elektronen mit allen Atomen im Molekül assoziiert sind. Diese Delokalisierung lässt den Benzolring chemische Bindungen mit ähnlichen Bindungslängen aufweisen.
Was ist der Unterschied zwischen lokalisierten und delokalisierten Elektronen?
Wir verwenden Begriffe lokalisierte und delokalisierte Elektronen unter dem Zweig der allgemeinen Chemie hinsichtlich der chemischen Struktur von Verbindungen. Ein lokalisiertes Atom ist ein Elektron, das zu einem bestimmten Atom gehört, während ein delokalisiertes Elektron ein Elektron ist, das nicht mit einem einzelnen Atom oder einer einzelnen kovalenten Bindung verbunden ist. Der Hauptunterschied zwischen lokalisierten und delokalisierten Elektronen besteht darin, dass sich lokalisierte Elektronen zwischen Atomen befinden, während sich delokalisierte Elektronen über und unter den Atomen befinden. Mit anderen Worten, lokalisierte Elektronen sind auf einen bestimmten Bereich zwischen zwei Atomen beschränkt, während die delokalisierten Elektronen über mehrere Atome verteilt sind.
Ein weiterer signifikanter Unterschied zwischen lokalisierten und delokalisierten Elektronen besteht darin, dass die lokalisierten Elektronen mit bestimmten Atomen in einer Verbindung assoziiert sind, während die delokalisierten Elektronen mit allen Atomen im Molekül assoziiert sind. Außerdem sind lokalisierte Elektronen grafisch durch gerade Linien angezeigt, während delokalisierte Elektronen durch Kreise grafisch angezeigt werden.
Die folgende Tabelle fasst die Unterschiede zwischen lokalisierten und delokalisierten Elektronen zusammen.

Zusammenfassung -lokalisierte und delokalisierte Elektronen
Die Begriffe lokalisierte und delokalisierte Elektronen werden unter General Chemistry erörtert. Der Hauptunterschied zwischen lokalisierten und delokalisierten Elektronen besteht darin, dass sich lokalisierte Elektronen zwischen Atomen befinden, während sich delokalisierte Elektronen über und unter den Atomen befinden. Darüber hinaus sind delokalisierte Elektronen mit bestimmten Atomen in einer Verbindung assoziiert, während die delokalisierten Elektronen mit allen Atomen im Molekül assoziiert sind.
Referenz:
1. „Lokalisierte und delokalisierte Einzelpaare und Bindungen.” Chemieschritte, 22. August. 2020, hier erhältlich.
2. „Delokalisierte Elektron.”Wikipedia, Wikimedia Foundation, 13. Juli 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Benz4" von Self -Made von Cacycle, Leyo - eigener Arbeit (CC BY -SA 3.0) über Commons Wikimedia


