Unterschied zwischen Schmelzpunkt und Gefrierpunkt

Der Schlüsselunterschied Zwischen Schmelzpunkt und Gefrierpunkt ist das Schmelzpunkt ist die Temperatur, bei der ein Feststoff in den flüssigen Zustand geht, während der Gefrierpunkt der Punkt ist, an dem jede Flüssigkeit ihren Zustand in einen Feststoff wechselt.
Phasenänderungen sind Prozesse, die Energiefreisetzung oder Energiegewinn beinhalten. Schmelzpunkt und Gefrierpunkt sind Punkte, an denen Phasenänderungen auftreten. Mit diesen können sich auch viele andere Eigenschaften des Materials ändern. Theoretisch sind der Gefrierpunkt und der Schmelzpunkt eines Materials gleich, aber manchmal für bestimmte Substanzen unterscheiden sich die beiden Werte voneinander.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Schmelzpunkt
3. Was ist Gefrierpunkt
4. Seite an Seitenvergleich - Schmelzpunkt gegen Gefrierpunkt in tabellarischer Form
5. Zusammenfassung
Was ist Schmelzpunkt?
Schmelzpunkt ist die Temperatur, bei der ein Feststoff in seinen flüssigen Zustand ändert. Es ist eine physikalische Eigenschaft, mit der wir eine Verbindung identifizieren können. Wenn ein Feststoff in eine Flüssigkeitsstufe umgewandelt wird, tritt eine Phasenänderung auf. Es tritt bei einer charakteristischen Temperatur für einen bestimmten Druck auf. Dafür müssen wir die erforderliche Energie liefern.
Die Phasenänderung absorbiert Energie/ Wärme (endotherm), wenn sie von fest zu flüssig wechselt. In den meisten Fällen wird diese Energie in Form von Wärme geliefert. Wärme ist erforderlich, um die Temperatur des Feststoffs auf seinen Schmelzpunktzustand zu erhöhen. Darüber hinaus braucht die Substanz die Energie, um sich selbst zu schmelzen. Wir nennen diese Energiewärme der Fusion; Dies ist eine Art latente Wärme.
Latente Wärme ist die Wärme, die während einer Phasenänderung aus einer Substanz absorbiert oder freigesetzt wird. Diese Wärmeänderungen verursachen keine Temperaturänderungen, da sie absorbiert oder freigesetzt werden. Daher absorbiert die Substanz am Schmelzpunkt Wärme, aber die Temperatur ändert sich nicht entsprechend. Thermodynamisch am Schmelzpunkt ist die Veränderung der freien Energie von Gibbs Null. Die folgende Gleichung gilt für ein Material am Schmelzpunkt. Es zeigt, dass sich die Temperatur nicht ändert, sondern die Enthalpie und Entropie der Materialänderung.
ΔS = ΔH/T
Da die Substanz Energie absorbiert, nimmt die Enthalpie am Schmelzpunkt zu. Im Feststaat sind Partikel gut geordnet und haben weniger Bewegung. Aber im flüssigen Zustand nimmt ihre zufällige Natur zu. Daher nimmt am Schmelzpunkt die Entropie zu. Nach dem Druck gibt es einen spezifischen Schmelzpunkt für ein bestimmtes Material. Wir können nur die Schmelzpunkte für Festkörper bestimmen.
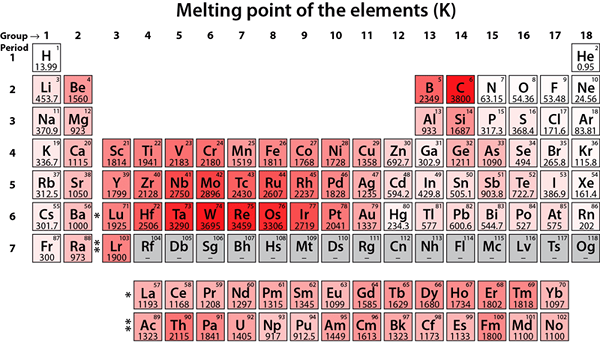
Abbildung 01: Schmelzpunkte verschiedener chemischer Elemente
Im Labor können wir viele Techniken verwenden, um den Schmelzpunkt zu bestimmen. Die Verwendung eines Schmelzpunktgeräts ist sehr einfach. Wir können etwas fein pulverisiertes Feststoff in eine Kapillare geben, in der ein Ende versiegelt ist. Dann sollten wir das versiegelte Ende, das den Feststoff in den Apparat enthält. Hier sollte das Ende das Metall im Inneren berühren. Danach können wir den Feststoff durch das Lupenfenster des Geräts beobachten. Es gibt auch ein Thermometer, um die Temperatur aufzuzeichnen. Wenn die Temperatur allmählich ansteigt, wird das Metall erwärmt, und der Feststoff in der Kapillare erhitzt ebenfalls. Wir können den Punkt beobachten, an dem das Schmelzen beginnt und endet. Und dieser Bereich entspricht dem Schmelzpunkt. Der Schmelzpunkt des Wassers beträgt 0 ° C. Wolfram hat den höchsten Schmelzpunkt, der 3410 ° C beträgt.
Was ist Gefrierpunkt?
Der Gefrierpunkt ist die Temperatur, bei der jede Flüssigkeit ihren Zustand in einen Feststoff wechselt. Die Temperatur des Schmelzpunkts und des Gefrierpunkts für ein Material beträgt mehr oder weniger der gleiche Wert. Zum Beispiel wird das Wasser bei 0 ° C in Eis und sein Schmelzpunkt beträgt ebenfalls 0 ° C. Genauer gesagt beschreibt der Gefrierpunkt die Änderung der Phase der Materie.

Abbildung 02: Einfrieren von Wasser bildet Eis
Darüber hinaus verringert der Prozess des Einfrierens einer Substanz die Entropie. Es gibt einen Begriff in der Chemie als „Gefrierpunktdepression“, die erklärt.
Was ist der Unterschied zwischen Schmelzpunkt und Gefrierpunkt?
Schmelzpunkt und Gefrierpunkt sind entgegengesetzte Richtungen derselben Phasenänderung. Der Hauptunterschied zwischen Schmelzpunkt und Gefrierpunkt besteht darin. Darüber hinaus gibt es auch einen Unterschied zwischen Schmelzpunkt und Gefrierpunkt in Bezug auf ihre Entropieänderung. Während des Schmelzens eines Feststoffs nimmt die Entropie zu, aber beim Einfrieren nimmt die Entropie ab. Außerdem, wenn auch theoretisch, sind Schmelzpunkt- und Gefrierpunkttemperaturen für ein bestimmtes Material ähnlich, praktisch variieren sie leicht.
Zusammenfassung -Schmelzpunkt gegen Gefrierpunkt
Schmelzpunkt und Gefrierpunkt sind zwei physikalische Eigenschaften von Substanzen. Der Hauptunterschied zwischen Schmelzpunkt und Gefrierpunkt besteht darin.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Was ist der Gefrierpunkt des Wassers??”Thoughtco, Oktober. 5, 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Schmelzpunkt der Elemente (k)" von Albris - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "1550739" (CC0) über Pxhere


