Unterschied zwischen Molarität und Molalität

Der Schlüsselunterschied zwischen Molarität und Molalität ist, dass Molarität ist Die Anzahl der in 1 Liter Lösung vorhandenen Mol aus gelösten Stoff, während Molalität die Anzahl der in 1 kg Lösungsmittel vorhanden.
Molarität und Molalität sind Maßnahmen für Lösungskonzentrationen. Die Konzentration einer Lösung ergibt die Menge der gelösten gelösten gelösten gelösten Stoffe in einer Lösungmenge. Die beiden Maßnahmen unterscheiden sich je nach dem Parameter, mit dem wir die Lösungseinheit messen. Molarität berücksichtigt das Volumen der Lösung, während die Molalität die Masse des Lösungsmittels berücksichtigt. In beiden Fällen messen wir jedoch die Anzahl der gelösten Stoffe in Molen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Molarität
3. Was ist Molalität
4. Seite an Seitenvergleich - Molarität gegen Molalität in tabellarischer Form
5. Zusammenfassung
Was ist Molarität?
Molarität ist die Konzentration einer Lösung, die durch die Anzahl der in einem Liter der Lösung vorhanden. Daher messen wir die Konzentration einer Lösung mittels Volumen bei der Bestimmung der Molarität. Die Messeinheit ist mol/l.

Abbildung 01: Unterschiedliche Lösungen haben je nach Volumen der Lösung unterschiedliche Konzentrationen
Darüber hinaus hängt dieser Parameter von der Temperatur der Lösung ab, da das Volumen einer Lösung mit der Temperatur variieren kann, i.e. Fast immer das Volumen der Flüssigkeiten dehnt sich mit zunehmender Temperatur aus. Beispielsweise hat eine Lösung, die zwei in einem Liter Lösung gelöste Mol gelöst wurde, 2.0 mol/l Konzentration. Wir können die Molarität durch „M“ bezeichnen.
Was ist Molalität?
Molalität ist die Konzentration einer Lösung, die durch die Menge der gelösten gelösten gelösten in einem kilogramm lösungsmittel vorhanden ist. Daher messen wir die Konzentration einer Lösung mittels der Masse des Lösungsmittels bei der Bestimmung der Molalität der Lösung. Daher ist die Messeinheit mol/kg.
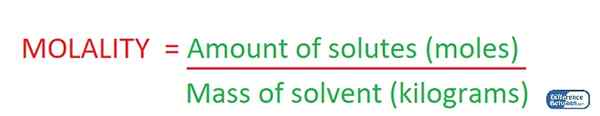
Abbildung 02: Bestimmung der Molalität einer Lösung
Darüber hinaus hängt dieser Parameter nicht von der Temperatur der Lösung ab, da sich die Masse nicht mit der Temperatur ändert. Wenn beispielsweise eine Lösung 2 Mol von gelösten Stoffen in einem Kilogramm Lösungsmittel enthält, beträgt die Konzentration 2.0 mol/kg. Wir bezeichnen diesen Begriff normalerweise als "M".
Was ist der Unterschied zwischen Molarität und Molalität?
Molarität ist die Konzentration einer Lösung, die durch die Menge der in einem Liter der Lösung vorhandenen gelösten gelösten Stoffe angegeben ist, während Molalität die Konzentration einer Lösung ist, die durch die Menge der in einem Kilogramm Lösungsmittel vorhanden. Daher ist dies der Schlüsselunterschied zwischen Molarität und Molalität. Darüber hinaus besteht ein wichtiger Unterschied zwischen Molarität und Molalität darin, dass die Molarität von der Temperatur einer Lösung abhängt, während die Molalität unabhängig von der Temperatur ist. Dies liegt hauptsächlich daran, dass sich das Volumen mit zunehmender Temperatur erweitern kann, während die Masse bei Temperaturänderungen konstant bleibt.
Die folgende Infografik zeigt den Unterschied zwischen Molarität und Molalität in tabellarischer Form.
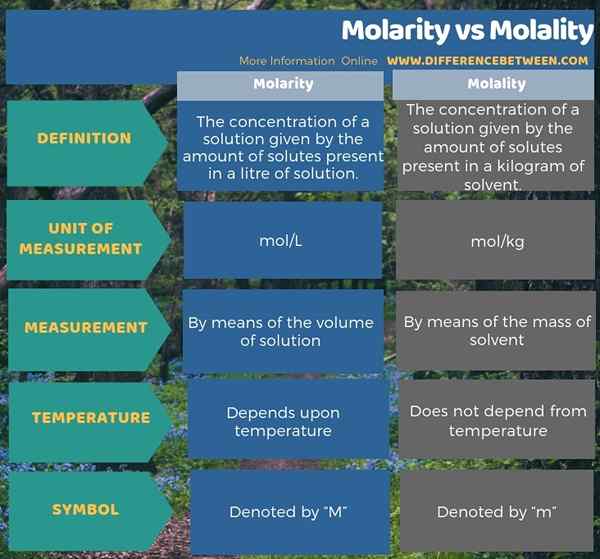
Zusammenfassung -Molarität gegen Molalität
Molarität und Molalität sind Maßnahmen für Lösungskonzentrationen. Der Schlüsselunterschied zwischen Molarität und Molalität besteht darin, dass die Molarität die Anzahl der in 1 Liter Lösung vorhandenen Mol von gelösten gelösten gelösten ist, während die Molalität die Anzahl der in 1 kg Lösungsmittel vorhanden.
Referenz:
1. Mott, Vallerie. „Einführung in die Chemie.”Lumen. Hier verfügbar
2. "Molare Konzentration.Wikipedia, Wikimedia Foundation, 17. Oktober. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”217043" von PublicDomainPictures (CC0) über Pixabay


