Unterschied zwischen molekularem Orbital und atomarem Orbital

Der Schlüsselunterschied Zwischen molekularem Orbital und Atomumkühlung ist das Atom -Orbitale beschreiben die Stellen, an denen die Wahrscheinlichkeit, die Elektronen zu finden.
Die Bindung an Molekülen wurde auf neue Weise mit den neuen Theorien von Schrodinger, Heisenberg und Paul Dirac verstanden. Als die Quantenmechanik mit ihren Ergebnissen ins Bild kam, wurde festgestellt, dass ein Elektron sowohl Partikel- als auch Welleneigenschaften hat. Daher entwickelte Schrodinger Gleichungen, um die Wellen Natur eines Elektrons zu finden, und entwickelte die Wellengleichung und die Wellenfunktion. Wellenfunktion (ψ) entspricht verschiedenen Zuständen für das Elektron.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein molekulares Orbital
3. Was ist ein atomares Orbital
4. Seite an Seitenvergleich - Molekulares Orbital gegen Atomkugel in tabellarischer Form
5. Zusammenfassung
Was ist ein molekulares Orbital?
Atome verbinden sich zu Molekülen. Wenn sich zwei Atome näher zusammenbringen, um ein Molekül zu bilden, überlappen sich Atomorbitale und verbinden. Die Anzahl der neu gebildeten molekularen Orbitale entspricht der Anzahl der kombinierten atomaren Orbitale. Darüber hinaus umgibt das molekulare Orbital die beiden Kerne der Atome, und Elektronen können sich um beide Kerne bewegen. Ähnlich wie atomare Orbitale enthalten molekulare Orbitale maximal 2 Elektronen, die entgegengesetzte Spins haben.
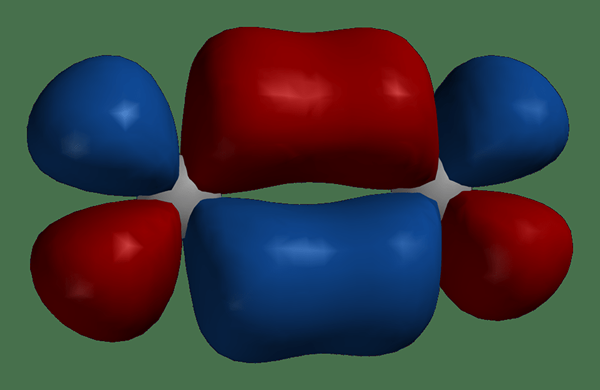
Abbildung 01: Molekulare Orbitale in einem Molekül
Darüber hinaus gibt es zwei Arten von molekularen Orbitalen: Bindungsmolekülorbitale und Antibindungsmolekülorbitale. Bindungsmolekülorbitale enthalten Elektronen im Grundzustand, während die Antibindungsmolekülorbitale keine Elektronen im Grundzustand enthalten. Darüber hinaus können Elektronen Antibindungsorbitale einnehmen, wenn sich das Molekül im angeregten Zustand befindet.
Was ist ein atomares Orbital?
Max Born zeigte auf eine physikalische Bedeutung für das Quadrat der Wellenfunktion (ψ2), nachdem Schrodinger seine Theorie vorgebracht hatte. Laut Born drückt ψ2 die Wahrscheinlichkeit aus, ein Elektron an einem bestimmten Ort zu finden; Wenn ψ2 ein großer Wert ist, ist die Wahrscheinlichkeit, das Elektron in diesem Raum zu finden. Daher ist im Raum die Dichte der Elektronenwahrscheinlichkeit groß. Wenn der ψ2 jedoch niedrig ist, ist die Elektronenwahrscheinlichkeitsdichte niedrig. Die Diagramme von ψ2 in x-, y- und z -Achsen zeigen diese Wahrscheinlichkeit. Wir nennen diese atomaren Orbitale.

Abbildung 02: verschiedene Atomorbitale
Darüber hinaus definieren wir ein Atom -Orbital als Raumbereich, in dem die Wahrscheinlichkeit, ein Elektron in einem Atom zu finden, groß ist. Wir können diese Orbitale nach Quantenzahlen charakterisieren, und jedes Atom -Orbital kann zwei Elektronen mit entgegengesetzten Spins aufnehmen. Wenn wir beispielsweise die Elektronenkonfiguration schreiben, schreiben wir sie als 1S2, 2S2, 2p6, 3S2. 1, 2, 3… .n Ganzzahlwerte sind die Quantenzahlen. Das Superscript nach dem Orbitalnamen zeigt die Anzahl der Elektronen in diesem Orbital. S-Orbitale sind kugelförmig und klein, während P-Orbitale mit zwei Lappen baulich geformt sind. Hier ist ein Lappen positiv, während der andere Lappen negativ ist. Darüber hinaus ist der Ort, an dem sich zwei Lappen berühren, der Knoten. Es gibt 3 P -Orbitale als x, y und z. Sie sind im Weltraum so angeordnet, dass ihre Achsen senkrecht zueinander sind.
Es gibt fünf D -Orbitale und 7 F -Orbitale mit unterschiedlichen Formen. Im Folgenden finden Sie die Gesamtzahl der Elektronen, die sich in einem Orbital befinden können.
- S Orbital-2 Elektronen
- P-Orbitale- 6 Elektronen
- D Orbitale- 10 Elektronen
- F Orbitale- 14 Elektronen
Was ist der Unterschied zwischen molekularem Orbital und atomarem Orbital?
Der Hauptunterschied zwischen molekularem Orbital und Atomdombital besteht darin, dass Atomorbitale die Stellen beschreiben, an denen die Wahrscheinlichkeit, die Elektronen zu finden. Darüber hinaus sind Atomorbitale in Atomen vorhanden, während molekulare Orbitale in Molekülen vorhanden sind. Darüber hinaus führt die Kombination von Atomorbitalen zur Bildung molekularer Orbitale. Darüber hinaus werden Atomorbitale als S, P, D und F bezeichnet, während es zwei Arten von molekularen Orbitalen als Bindungs- und Antibindungsmolekülorbitale gibt.
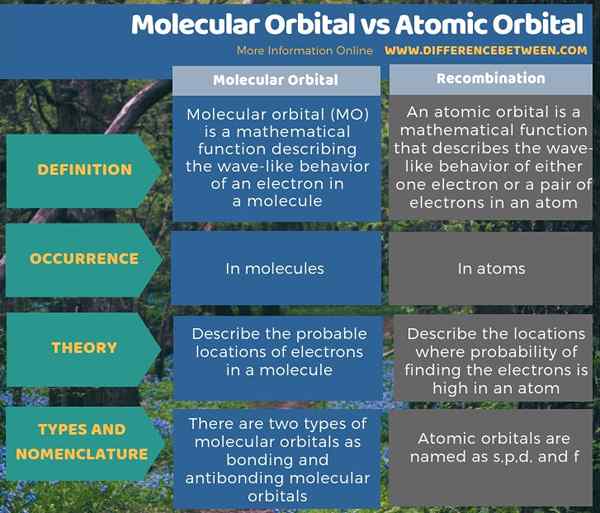
Zusammenfassung -Molekulares Orbital gegen Atomkugel
Der Hauptunterschied zwischen molekularem Orbital und Atomdombital besteht darin, dass Atomorbitale die Stellen beschreiben, an denen die Wahrscheinlichkeit, die Elektronen zu finden.
Referenz:
1. Helmenstine, Anne Marie. „Orbital Definition und Beispiel.Denkweise Mai. 7, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „Raumfüllungsmodell einer PI-Bindung (Bindungsmolekularkörpa mit π-Symmetrie), die durch die Überlappung von…“ von Ben Mills (Public Domain) über Öffentlichkeitsdateien erzeugt wird
2. "Atomic-Orbital-Clouds SPD M0" von Geek3-eigene Arbeit; Erstellt mit Wasserstoffwolken in Pythonthis PNG-Grafik wurde mit Python (CC BY-SA 4) erstellt.0) über Commons Wikimedia


