Unterschied zwischen Molekül und Gitter

Der Schlüsselunterschied Zwischen Molekül und Gitter ist das a Das Molekül enthält Atome, die miteinander gebunden sind, während ein Gitter Atome, Moleküle oder Ionen enthält, die miteinander gebunden sind.
Atome verbinden sich zusammen zu verschiedenen chemischen Substanzen. Nach ihrer Vereinbarung ändern sich ihre Eigenschaften. Die einfachste Einheit, die sich bilden kann, wenn Atome miteinander binden. Wenn sich eine sehr große Anzahl von Atomen, Ionen oder Molekülen miteinander verbinden, ist das Ergebnis ein Gitter. Ein Gitter hat eine hoch geordnete Struktur und eine sehr hohe Molmasse.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein Molekül
3. Was ist ein Gitter
4. Nebenseitiger Vergleich - Molekül gegen Gitter in tabellarischer Form
5. Zusammenfassung
Was ist ein Molekül?
Moleküle bestehen aus chemisch gebundenen zwei oder mehr Atomen desselben Elements (e.G., Ö2, N2) oder verschiedene Elemente (h2O, NH3). Moleküle haben keine Ladung und die Atome binden über kovalente Bindungen miteinander. Darüber hinaus können sie sehr groß sein (Hämoglobin) oder sehr klein (h2) abhängig von der Anzahl der Atome, die miteinander verbunden sind.

Abbildung 01: ein Wassermolekül
Die molekulare Formel eines Moleküls zeigt den Typ und die Anzahl der Atome in einem Molekül. Die empirische Formel ergibt das einfachste Ganzzahlverhältnis der in einem Molekül vorhandenen Atome. Zum Beispiel c6H12Ö6 ist die molekulare Formel von Glukose und CH2O ist die empirische Formel. Molekulare Masse ist die Masse, die wir unter Berücksichtigung der Gesamtzahl der Atome in der molekularen Formel berechnen. Darüber hinaus hat jedes Molekül seine eigene Geometrie. Darüber hinaus ordnen die Atome in Molekül auf eine sehr stabil.
Was ist ein Gitter?
Gitter ist ein großes Netzwerk von Atomen, das eine geordnete Struktur hat. In der Chemie können wir verschiedene Arten von ionischen und kovalenten Gitter sehen. Wir können ein Gitter als einen Feststoff definieren, der eine dreidimensionale geordnete Anordnung von Grundeinheiten hat. Die Grundeinheit kann ein Atom, ein Molekül oder ein Ion sein. Somit sind Gitter kristalline Strukturen mit diesen wiederholten Grundeinheiten.
Wenn dieses Netzwerk Ionen enthält, die mit ionischen Bindungen verbunden sind, nennen wir sie als ionische Kristalle. Zum Beispiel ist Natriumchlorid ein ionisches Gitter. Natrium ist ein Metall der Gruppe 1 und bildet daher ein +1 geladenes Kation als stabilste Kation. Chlor ist ein Nichtmetall und kann einen -1 -geladenen Anion bilden. Im Gitter umgeben sechs Chloridionen jedes Natriumion und umgekehrt. Aufgrund aller elektrostatischen Attraktionen zwischen Ionen ist die Gitterstruktur sehr stabil. Die Anzahl der im Gitter vorhandenen Ionen variiert mit der Größe davon. Gitterenergie oder Enthalpie des Gitters ist das Maß für die Stärke der ionischen Bindungen im Gitter. Normalerweise ist Gitterenthalpie exotherm.
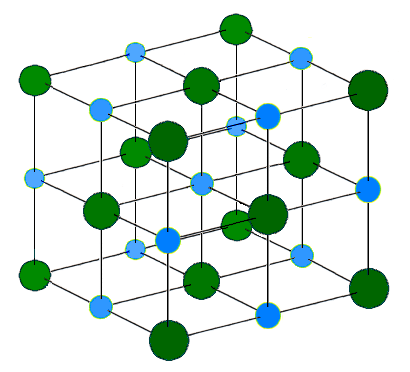
Abbildung 02: Natriumchloridgitterstruktur
Diamant und Quarz sind zwei Beispiele für dreidimensionale kovalente Gitter. Diamond besteht aus nur Kohlenstoffatomen, und jedes Kohlenstoffatom bindet kovalent an vier andere Kohlenstoffatome, um die Gitterstruktur zu bilden. So hat jedes Kohlenstoffatom die tetraedrische Anordnung. Diamond hat aufgrund dieser Struktur eine hohe Stabilität. (Diamond ist einer der stärksten Mineralien der Erde.) Quarz oder Siliziumdioxid hat auch kovalente Bindungen, aber diese Bindungen bestehen zwischen Silizium- und Sauerstoffatomen (Gitter verschiedener Atome). Beide kovalenten Gitter haben einen sehr hohen Schmelzpunkt und können keinen Strom leiten.
Was ist der Unterschied zwischen Molekül und Gitter?
Ein Molekül bildet sich, wenn zwei oder mehr Atome entweder über kovalente chemische Bindungen oder ionische Bindungen miteinander binden. Andererseits bildet sich ein Gitter, wenn sich eine große Anzahl von Atomen, Molekülen oder Ionen miteinander verbinden, um eine reguläre Netzwerkstruktur zu bilden. Daher besteht der Hauptunterschied zwischen Molekül und Gitter darin, dass Moleküle miteinander verbunden sind, während Gitter Atome, Moleküle oder Ionen enthalten, die miteinander gebunden sind.
Als ein weiterer wichtiger Unterschied zwischen Molekül und Gitter können wir sagen, dass Molekül als Feststoffe, Flüssigkeiten oder Gase auftreten kann, während Gitter nur als Feststoff auftreten. Darüber hinaus ist die Masse eines Moleküls im Vergleich zur Masse eines Gitters sehr niedrig, da die Anzahl der Atome in einem Gitter vergleichsweise sehr hoch ist.
Weitere Unterschiede sind nachstehend in der Infografik des Unterschieds zwischen Molekül und Gitter gezeigt.
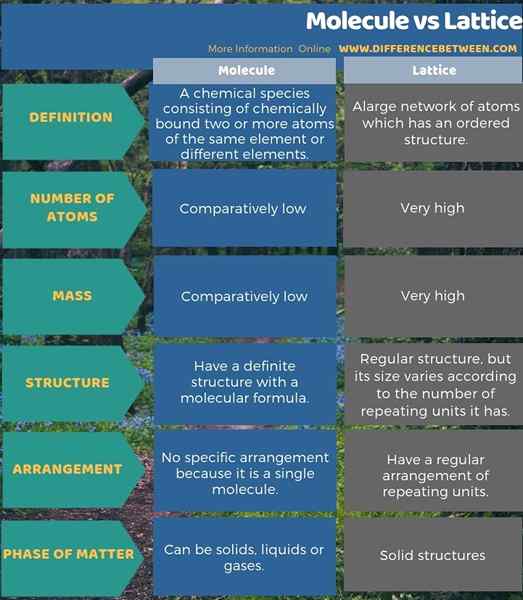
Zusammenfassung - Molekül gegen Gitter
Moleküle und Gitter sind zwei wichtige chemische Begriffe in der Chemie. Sie unterscheiden sich voneinander; Daher können wir sie nicht austauschbar verwenden. Der Hauptunterschied zwischen Molekül und Gitter besteht darin, dass Moleküle miteinander verbunden sind, während Gitter Atome, Moleküle oder Ionen enthalten, die miteinander gebunden sind.
Referenz:
1. Libretexten. „Ionische Strukturen.”Chemistry Libretexten, National Science Foundation, 19. Juni 2017. Hier verfügbar
2. Helmenstine, Anne Marie, ph.D. „Was ist ein Molekül?”Thoughtco, Jun. 11, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Wassermolekül 3D" von DBC334 (erste Version); Jynto (zweite Version)-Water-3D-VDW.PNG (Public Domain) über Commons Wikimedia
2."Natriumchloridkristall" von H Padellockas (Public Domain) über Commons Wikimedia


