Unterschied zwischen isoliertem System und geschlossenem System
Der Schlüsselunterschied zwischen isoliertem System und geschlossenem System ist das Die isolierten Systeme können nicht sowohl Materie als auch Energie mit der Umgebung austauschen, aber obwohl auch die geschlossenen Systeme mit der Umgebung keine Materie austauschen können, kann sie die Energie austauschen.
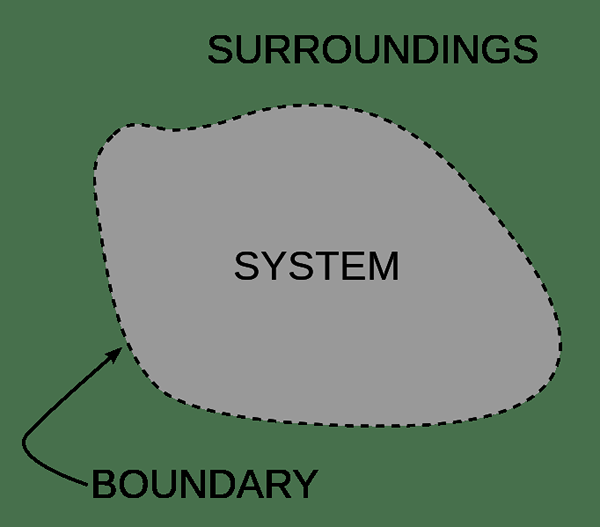
Für die Leichtigkeit des Studiums der Chemie teilen wir das Universum in zwei Teile ein. Der Teil, den wir studieren werden, ist das „System“, und der Rest ist die „Umgebung“. Zum Beispiel kann ein System ein Organismus, ein Reaktionsgefäß oder sogar eine einzelne Zelle sein. Es gibt eine Grenze zwischen einem System und der Umgebung. Die Grenze definiert den Umfang des Systems. Manchmal austauschen die Materie und der Energieaustausch durch diese Grenzen. Darüber hinaus können wir ein System in zwei Kategorien eintreffen. Sie sind das offene System und das geschlossene System. Ein isoliertes System ist eine Form eines geschlossenen Systems.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein isoliertes System
3. Was ist geschlossenes System
4. Seite für Seitenvergleich - Isoliertes System gegen geschlossenes System in tabellarischer Form
5. Zusammenfassung
Was ist ein isoliertes System?
Ein isoliertes System ist eine Form eines geschlossenen Systems. Es unterscheidet sich jedoch von einem geschlossenen System, weil es weder mechanischer noch thermischen Kontakt mit seiner Umgebung hat. Das bedeutet; Die isolierten Systeme können sowohl Materie als auch Energie mit der Umgebung austauschen. Darüber hinaus erreichen diese Systeme das thermodynamische Gleichgewicht mit der Zeit, indem sie den Druck, die Temperatur oder andere Parameter ausbalancieren.
Praktisch existiert ein isoliertes System nicht, da alle Dinge auf bestimmte Weise miteinander interagieren. Wir können das gesamte Universum jedoch als ein isoliertes System betrachten, wenn man bedenkt, dass keine Materie und Energie außerhalb des Universums übertragen werden. Theoretisch ist dies bei der Erstellung von Modellen nützlich. Zum Beispiel beschreiben die ersten und zweiten thermodynamischen Gesetze ein isoliertes System.
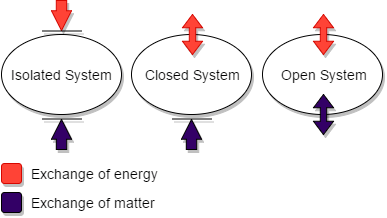
Abbildung 01: Vergleich des isolierten Systems mit offenen und geschlossenen Systemen
Der Erstes Gesetz der Thermodynamik erklärt, dass die „interne Energie eines isolierten Systems konstant ist." Der Zweites Gesetz der Thermodynamik sagt: „Die Entropie eines isolierten Systems nimmt im Verlauf eines spontanen Prozesss zu.Dieses Gesetz gilt jedoch nur für isolierte Systeme. Die Entropie steigt im Laufe der Zeit in einem isolierten System und erreicht den Maximalwert im Gleichgewicht. Kurz gesagt kann die Gesamtenergie dieser Systeme niemals zunehmen. Somit kann die Entropie niemals abnehmen.
Was ist geschlossenes System?
In einem geschlossenen System kann Materie die Grenze nicht durchlaufen. Daher ist die Angelegenheit in einem geschlossenen System immer gleich. In dieser Art von System wird jedoch der Energieaustausch mit der Umgebung austauschend. Wenn beispielsweise eine Reaktion auftritt, kann sich das System ausdehnen oder die Energie in die Umgebung übertragen.

Abbildung 02: Ein System und seine Umgebung durch eine Grenze getrennt
Beispiel: Wenn wir die Oberseite einer warmen Tasse Tee mit einem Deckel bedecken, wird es zu einem geschlossenen System. Dort kann der Dampf dem System nicht entkommen. Außerdem können die Gasmoleküle in der Umgebung nicht in das System gelangen. Daher gibt es keinen Materieaustausch. Die Hitze des Teeaustauschs mit der Umgebung. Wir können die Hitze spüren, wenn wir den Deckel der Tasse berühren. Daher kommt die Energie draußen als thermische Energie. Dort erreicht das System ein Gleichgewicht mit der Umgebung, wenn die Temperatur innerhalb und außerhalb des Systems gleich wird.
Was ist der Unterschied zwischen isoliertem System und geschlossenem System?
Eine Grenze trennt ein System und seine Umgebung. Wir können ein System je nach Austausch von Materie und Energie über diese Grenze als offenes oder geschlossenes System nennen. Ein isoliertes System ist auch eine Form eines geschlossenen Systems. Der Hauptunterschied zwischen isoliertem System und geschlossenem System besteht darin, dass die isolierten Systeme mit der Umgebung nicht sowohl Materie als auch Energie austauschen können, obwohl die geschlossenen Systeme, obwohl die geschlossenen Systeme keine Materie mit der Umgebung austauschen können, die Energie austauschen kann.
Als ein weiterer wichtiger Unterschied zwischen isoliertem System und geschlossenem System können wir sagen, dass die Entropie eines isolierten Systems niemals abnehmen kann, während die Entropie eines geschlossenen Systems abnehmen kann. Darüber hinaus sind isolierte Systeme theoretisch; Das heißt, diese Systeme existieren in der Realität nicht. In der Realität existieren jedoch geschlossene Systeme.
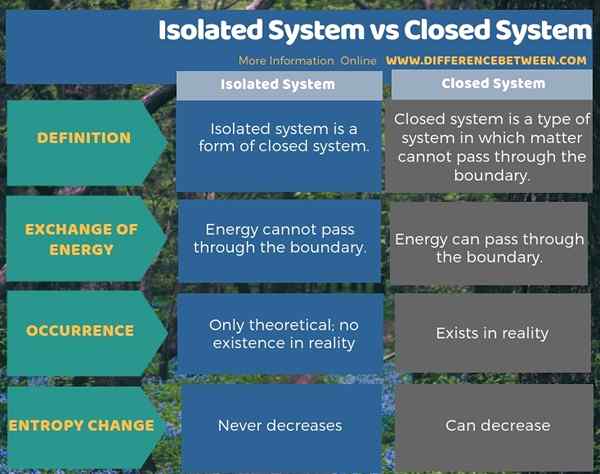
Zusammenfassung -isoliertes System gegen geschlossenes System
Systeme sind zwei Arten; Sie sind das offene System und das geschlossene System. Isolierte Systeme sind auch eine Art geschlossenes System. Es gibt jedoch nur wenige Unterschiede zwischen ihnen. Der wichtigste Unterschied zwischen isoliertem System und geschlossenem System besteht darin, dass die isolierten Systeme mit der Umgebung nicht sowohl Materie als auch Energie austauschen können, obwohl auch die geschlossenen Systeme mit der Umgebung keine Materie austauschen können, aber die Energie austauschen kann.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Definition des geschlossenen Systems (Wissenschaft).”Thoughtco, Jun. 22, 2018. Hier verfügbar
2. Helmenstine, Anne Marie, ph.D. „Isolierte Systemdefinition.”Thoughtco, Jul. 12, 2017. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Diagrammsysteme" von Alkh.Alwa - eigene Arbeit, (CC BY -SA 4.0) über Commons Wikimedia
2."Systemgrenze" von Wavesmikey (öffentlich zugänglich) über Commons Wikimedia


