Unterschied zwischen N2O4 und NO2
Der Schlüsselunterschied Zwischen N2O4 und NO2 ist das N2O4 ist diamagnetisch, während NO2 paramagnetisch ist.
N2O4 ist Dinitrogen -Tetroxid, während No2 Stickstoffdioxid ist. Obwohl die chemische Formel N2O4 durch Verdoppelung der stöchiometrischen Werte der chemischen Formel NO2 erhalten werden kann, sind diese beiden unterschiedliche chemische Verbindungen mit unterschiedlichen chemischen und physikalischen Eigenschaften.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist N2O4
3. Was ist NO2
4. Seite an Seitenvergleich - N2O4 gegen NO2 in tabellarischer Form
5. Zusammenfassung
Was ist N2O4?
N2O4 ist Dinitrogen -Tetroxid. Wir nennen es üblicherweise als Stickstofftetroxid. Diese Verbindung tritt als farblose Flüssigkeit auf und ist ein sehr nützliches Reagenz in chemischen Syntheseprozessen. Diese Verbindung kann ein Gleichgewichtsgemisch mit Stickstoffdioxid bilden. Darüber hinaus ist Dinitrogen -Tetroxid ein starkes Oxidationsmittel, das auch hypergolisch ist. Es ist hypergolisch bei Kontakt mit verschiedenen Formen von Hydrazin (dies macht die Mischung aus Hydrazin und Dinitrogen -Tetroxid zu einem gemeinsamen Zweibetuch für Raketen).
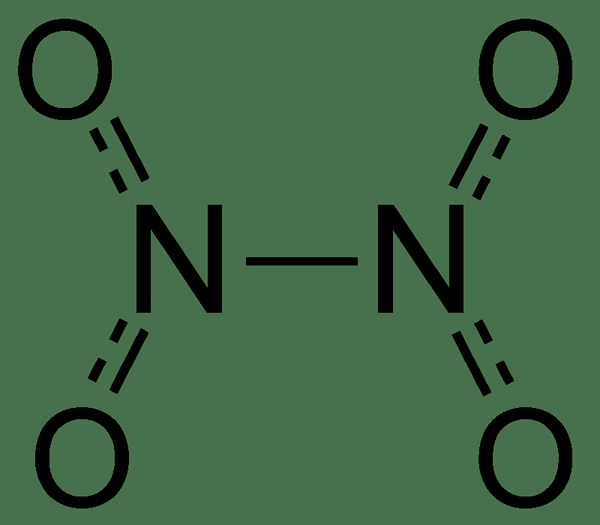
Abbildung 01: Molekularanbau von Dinitrogen -Tetroxidmolekül
Wir können das Dinitrogen -Tetroxidmolekül als zwei Nitrogruppen ansehen, die miteinander verbunden sind. Und diese bestimmte Reaktion bildet eine Gleichgewichtsgemisch aus Dinitickstofftetroxid und Stickstoffdioxid. Außerdem können wir das Dinitrogen -Tetroxidmolekül als planares Molekül mit einer schwachen Bindung zwischen zwei Stickstoffatomen beobachten. Dies liegt daran.
Bei der Betrachtung der magnetischen Eigenschaften dieses Molekül. Darüber hinaus ist diese flüssige Substanz normalerweise farblos, aber es kann auch eine gelbe färbliche Färbung aufgrund des Vorhandenseins von NO2 geben, abhängig vom oben genannten Gleichgewicht, das oben erwähnt wurde. Noch wichtiger ist, dass das Gleichgewicht bei erhöhten Temperaturen eher in Richtung NO2 als N2O4 drückt.
Dinitrogen -Tetroxid kann durch die katalytische Oxidation von Ammoniak erzeugt werden, wobei Dampf als Verdünnungsmittel verwendet wird, um die Verbrennungstemperatur zu verringern. In diesem Reaktionsprozess umfasst der erste Schritt Ammoniakoxidation in Stickoxid, und der zweite Schritt ist die Oxidation von Stickoxid in Stickstoffdioxid, gefolgt von Dimerisierung in Stickstofftetroxid.
Was ist NO2?
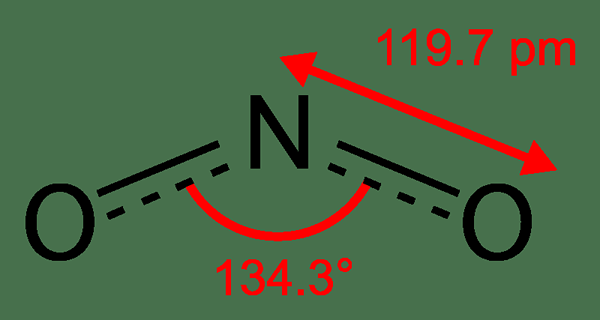
NO2 ist Stickstoffdioxid. Es ist einer der verschiedenen Stickstoffoxide. Wir können es als Zwischenprodukt in der industriellen Synthese von Salpetersäure beobachten, was für die Düngemittelproduktion wichtig ist. Darüber hinaus ist NO2 ein braunes Gas mit einem chlorähnlichen Geruch mit. Wenn diese Verbindung zu Wasser zugesetzt wird, unterliegt diese Verbindung einer Hydrolyse. Diese gasförmige Substanz wandelt sich jedoch bei niedrigen Temperaturen in eine gelblichbraune Flüssigkeit um. Und diese Farbänderung tritt aufgrund der Umwandlung von NO2 in N2O4 auf.

Abbildung 02: Chemische Struktur von NO2
Charakteristisch gesehen hat das Stickstoffatom des NO2 -Moleküls ein ungepaartes Elektron. Daher ist diese Verbindung paramagnetisch; Das heißt, es kann sich von einem externen Magnetfeld angezogen fühlen. Darüber hinaus bedeutet dieses einzelne ungepaarte Elektron, dass es sich um eine freie Radikale handelt.
Bei der Betrachtung der Herstellung von NO2 -Substanz bildet sie sich typischerweise über die Oxidation von Stickoxid durch Sauerstoff in der Luft. Außerdem bildet sich diese Substanz in den meisten Verbrennungsprozessen mit Luft als Oxidationsmittel.
Es gibt nur wenige unterschiedliche Verwendungen von NO2, einschließlich der Verwendung als Zwischenprodukt bei der Herstellung von Salpetersäure, als Nitrationsmittel bei der Herstellung chemischer Sprengstoff, als Polymerisationsinhibitor für Acrylate, als Mehlblitzmittel usw.
Was ist der Unterschied zwischen N2O4 und NO2?
N2O4 ist Dinitrogen -Tetroxid, während No2 Stickstoffdioxid ist. Der Schlüsselunterschied zwischen N2O4 und NO2 besteht darin, dass N2O4 diamagnetisch ist, während NO2 paramagnetisch ist. Ferner tritt N2O4 als Flüssigkeit auf, während No2 eine gasförmige Substanz ist. Darüber hinaus ist N2O4 eine farblose Flüssigkeit, während NO2 ein braunes Gas ist.
Die folgenden info-grafischen Tabuls mehr Unterschiede zwischen N2O4 und NO2 für Seite-Neben-Vergleiche.
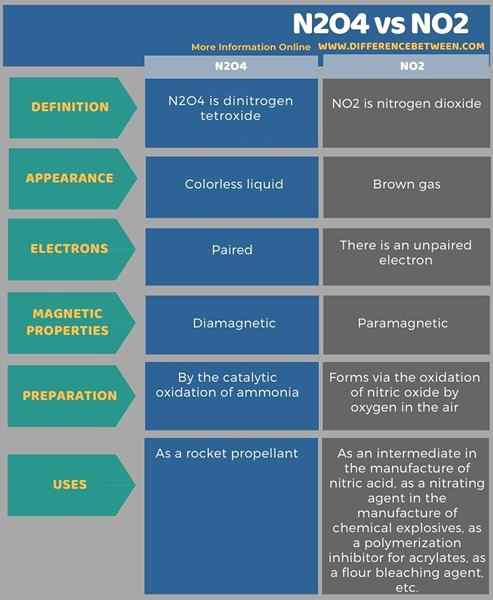
Zusammenfassung -N2O4 gegen NO2
N2O4 ist Dinitrogen -Tetroxid. NO2 ist Stickstoffdioxid. Bei der Betrachtung der chemischen Eigenschaften dieser beiden Verbindungen sind magnetische Eigenschaften sehr wichtig. Der Schlüsselunterschied zwischen N2O4 und NO2 besteht darin, dass N2O4 diamagnetisch ist, während NO2 paramagnetisch ist. Diamagnetische Mittelwerte Die N2O4 -Moleküle werden nicht von einem externen Magnetfeld angezogen, da in diesem Molekül keine ungepaarten Elektronen vorhanden sind. Paramagnetische Mittelwerte Das Molekül wird von einem externen Magnetfeld angezogen, da im NO2 -Molekül ein ungepaartes Elektron vorhanden ist.
Referenz:
1. „Dinitrogen -Tetroxid.”Pubchem, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Dinitrogen Tetroxid" von Kemikungen - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Nitrogen-Dioxid-2D-Dimensions-Vektor" von Zirguezi-eigene Arbeit (Public Domain) über Commons Wikimedia


