Unterschied zwischen NABH4 und LIALH4 -Reaktion
Der Schlüsselunterschied Zwischen NABH4- und LIALH4 -Reaktion ist das NABH4 ist ein schwacher Reduktionsmittel, während Lialh4 ein starker Reduktionsmittel ist.
Sowohl NABH4 als auch LIALH4 reduzieren die Wirkstoffe. Dies sind die häufigsten Quellen für Hydrid -Nucleophile, die wir bei organischen Synthesereaktionen verwenden. Der Name NABH4 ist Natriumborhydrid, während der Name von Lialh4 Lithium -Aluminiumhydrid ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist NABH4 -Reaktion
3. Was ist eine Reaktion von lialh4
4. Seite an Seitenvergleich - NABH4 gegen LIALH4 -Reaktion in tabellarischer Form
5. Zusammenfassung
Was ist NABH4 -Reaktion?
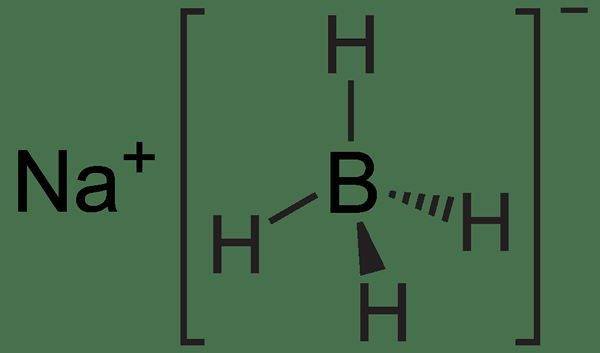
Die NABH4 -Reaktion ist eine Art Redoxreaktion, bei der NABH4 das Reduktionsmittel ist. Die chemische Formel NABH4 steht für Natriumborhydrid. Es ist eine der häufigsten Quellen für Hydrid -Nucleophile. Diese Verbindung hat eine polare Metallhydrogenbindung. Daher können wir während der Redoxreaktion das Hydridanion nicht finden; Somit dient dieses Reagenz aufgrund des Vorhandenseins dieser Metallhydrogenbindung als Hydridquelle. Wenn wir NABH4 jedoch mit LIALH4 vergleichen, ist die Metallhydrogenbindung von Lialh4 polarer; Somit ist es ein stärkerer Reduktionsmittel als NABH4. Dies liegt hauptsächlich daran.
Natriumborhydrid kann viele organische Carbonylverbindungen reduzieren. Typischerweise wird diese Substanz im Labor verwendet, um ein Keton oder einen Aldehyd in einen Alkohol umzuwandeln. Darüber hinaus können die Reaktionen von NABH4 Acylchloride, Anhydride, Thioester und Imine bei Raumtemperatur effizient reduzieren. Darüber hinaus reagiert NABH4 mit Wasser und Alkoholern und bildet Wasserstoffgas und ein Boratsalz.

Abbildung 01: Chemische Struktur von NABH4
Darüber hinaus wird bei NABH4 -Reaktionen ein Alkohol (z. Die Reaktivität von NABH4 kann jedoch durch verschiedene Verbindungen wie Methanol verstärkt oder verstärkt werden.
Was ist eine Reaktion von lialh4?
Lialh4 ist eine Art Redoxreaktion, bei der Lialh4 das Reduktionsmittel ist. Die chemische Formel LIALH4 steht für Lithium -Aluminiumhydrid. Es hat vier Metall-Wasserstoffbindungen, die aufgrund des Unterschieds in der Elektronegativität zwischen Lithium- und Wasserstoffatomen hoch polar sind. Dies macht die Verbindung zu einem starken Reduktionsmittel. Darüber hinaus existiert diese Verbindung als fest in Raumtemperatur, wo sie extrem auf das Wasser reagieren und Wasserstoffgas auf die Reaktion mit Wasser freigibt. Diese Reaktion ist aufgrund der hohen Reaktivität des Reaktionsgemisches sehr gefährlich.
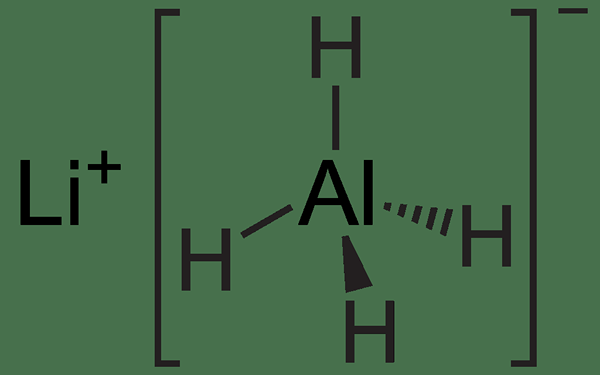
Abbildung 02: Chemische Struktur von lialh4
Lialh4 kann Ester, Carbonsäuren, Acylchloride, Aldehyde und Ketone in ihren entsprechenden Alkohol umwandeln. Darüber hinaus kann es Amide, Nitrilverbindungen, Azide und Nitroverbindungen in die entsprechenden Amine umwandeln.
Was ist der Unterschied zwischen NABH4 und LIALH4 -Reaktion?
NABH4 und LIALH4 sind die häufigsten Reduktionsmittel in der organischen Chemie. Der Hauptunterschied zwischen NABH4 und LIALH4 besteht darin. Beim Vergleich von NABH4 mit LIALH4 ist die Metallhydrogenbindung von Lialh4 polarer; Somit ist es ein stärkerer Reduktionsmittel als NABH4. Dies liegt hauptsächlich daran.
Die folgende Infografik ergibt einen detaillierten Vergleich im Zusammenhang mit dem Unterschied zwischen NABH4 und Lialh4.
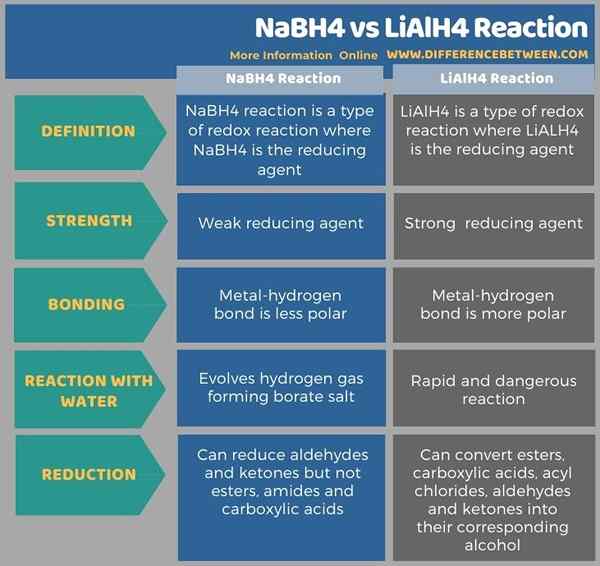
Zusammenfassung -NABH4 gegen LIALH4 -Reaktion
Ein Reduktionsmittel ist eine chemische Substanz, die eine andere Substanz reduzieren kann, während sie sich selbst oxidieren. NABH4 und LIALH4 sind die häufigsten Reduktionsmittel in der organischen Chemie. Der Hauptunterschied zwischen NABH4 und LIALH4 besteht darin.
Referenz:
1. Welker, Martin. „Organische Chemie II.” 3. Reduzierungen mit NABH4, LIALH4 | Organische Chemie ii. N.P., N.D. Netz. 26. Juni 2020.
Bild mit freundlicher Genehmigung:
1. "Natriumborhydrid" von Kemikungen - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Lithium aluminiumhydrid" von Kemikungen - eigene Arbeit (Public Domain) über Commons Wikimedia


