Unterschied zwischen Nitrat und Nitrit
Der Schlüsselunterschied Zwischen Nitrat und Nitrit ist das Nitrat enthält drei Sauerstoffatome, die an ein Stickstoffatom gebunden sind, während Nitrit zwei Sauerstoffatome enthält, die an ein Stickstoffatom gebunden sind.
Sowohl Nitrat als auch Nitrit sind anorganische Anionen, die aus Stickstoff- und Sauerstoffatomen bestehen. Beide Anionen haben eine elektrische Ladung -1. Sie treten hauptsächlich als Anionen von Salzverbindungen auf. Es gibt einige Unterschiede zwischen Nitrat und Nitrit; Wir werden diese Unterschiede in diesem Artikel diskutieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Nitrat
3. Was ist Nitrit
4. Seite für Seitenvergleich - Nitrat gegen Nitrit in tabellarischer Form
5. Zusammenfassung
Was ist Nitrat??
Nitrat ist ein anorganisches Anion mit der chemischen Formel Nr3-. Es ist ein polyatomisches Anion, das 4 Atome hat; ein Stickstoffatom und drei Sauerstoffatome. Der Anion hat -1 Gesamtgebühr. Die Molmasse dieses Anion beträgt 62 g/mol. Außerdem wird dieses Anion aus seiner Konjugatsäure abgeleitet; Salpetersäure oder HNO3. Mit anderen Worten, Nitrat ist die konjugierte Basis der Salpetersäure.
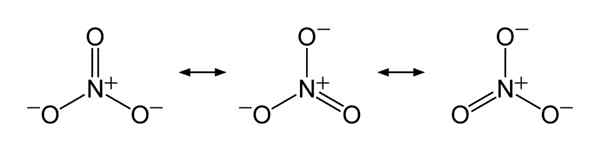
Kurz gesagt hat Nitration ein Stickstoffatom in der Mitte, das über kovalente chemische Bindung mit drei Sauerstoffatomen bindet. Bei der Betrachtung der chemischen Struktur dieses Anions hat es drei identische N-O-Bindungen (gemäß den Resonanzstrukturen des Anion). Daher ist die Geometrie des Moleküls trigonaler planar. Jedes Sauerstoffatom trägt ein - - 2⁄3 Ladung, die die Gesamtladung des Anion als -1 ergibt.

Abbildung 01: Resonanzstrukturen von Nitration
Bei Standarddruck und Temperatur löst sich fast alle Salzverbindungen, die dieses Anion enthalten. Wir können natürlich vorkommende Nitratsalze auf der Erde als Ablagerungen finden; Nitratinablagerungen. Es enthält hauptsächlich Natriumnitrat. Darüber hinaus kann nitrifizierende Bakterien Nitration produzieren. Eine der Hauptanwendungen der Nitratsalze ist die Produktion von Düngemitteln. Darüber hinaus ist es als Oxidationsmittel bei Sprengstoff nützlich.
Was ist Nitrit?
Nitrit ist ein anorganisches Salz mit der chemischen Formel Nr2-. Dieses Anion ist ein symmetrisches Anion und hat ein Stickstoffatom, das an zwei Sauerstoffatome mit zwei identischen n-o kovalenten chemischen Bindungen gebunden ist. Daher befindet sich das Stickstoffatom im Zentrum des Moleküls. Der Anion hat -1 Gesamtgebühr.
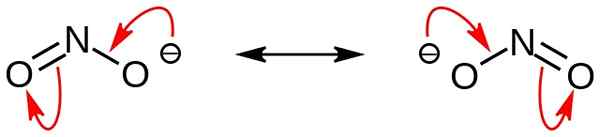
Abbildung 02: Resonanzstrukturen des Nitritionen
Die Molmasse des Anion beträgt 46.01 g/mol. Außerdem wird dieses Anion aus der Lacheräure oder HNO abgeleitet2. Daher ist es die konjugierte Basis der Lobsäure. Daher können wir industriell Nitritsalze produzieren, indem wir Lachdämpfe in wässrige Natriumhydroxidlösung übergeben. Darüber hinaus erzeugt dies Natriumnitrit, die wir durch Rekristallisation reinigen können. Darüber hinaus sind Nitritsalze wie Natriumnitrit bei der Erhaltung der Lebensmittel nützlich, da sie das mikrobielle Wachstum verhindern können.
Was ist der Unterschied zwischen Nitrat und Nitrit?
Nitrat ist ein anorganisches Anion mit der chemischen Formel Nr3- Während Nitrit ein anorganisches Salz mit der chemischen Formel Nr. ist2-. Daher liegt der Hauptunterschied zwischen Nitrat und Nitrit in der chemischen Zusammensetzung der beiden Anionen. Das ist; Der Schlüsselunterschied zwischen Nitrat und Nitrit besteht darin, dass Nitrat drei Sauerstoffatome enthält, die an ein Stickstoffatom gebunden sind, während Nitrit zwei Sauerstoffatome enthält, die an ein Stickstoffatom gebunden sind. Darüber hinaus wird Nitration von seiner Konjugatsäure abgeleitet; Die Salpetersäure, während das Nitrition von Liegensäure abgeleitet wird. Als ein weiterer wichtiger Unterschied zwischen Nitrat- und Nitritionen können wir sagen, dass Nitrat ein Oxidationsmittel ist.
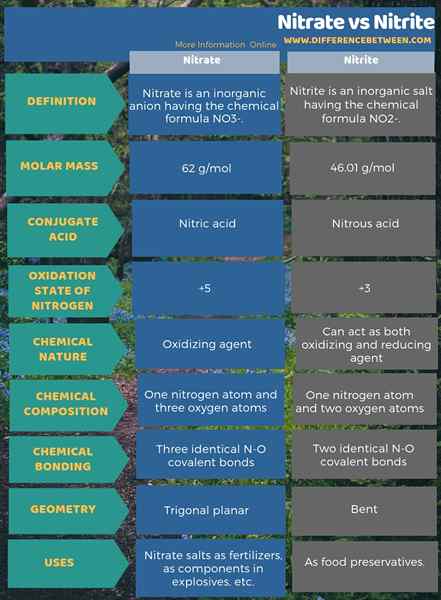
Zusammenfassung -Nitrat gegen Nitrit
Nitrat und Nitrit sind stickstoffhaltige Anionen, die hauptsächlich als Salzverbindungen auftreten. Der Schlüsselunterschied zwischen Nitrat und Nitrit besteht darin, dass Nitrat drei Sauerstoffatome enthält, die an ein Stickstoffatom gebunden sind, während Nitrit zwei Sauerstoffatome enthält, die an ein Stickstoffatom gebunden sind.
Referenz:
1. "Nitrat.Wikipedia, Wikimedia Foundation, 6. Oktober. 2018. Hier verfügbar
2. "Nitrit.”Wikipedia, Wikimedia Foundation, 1. November. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Nitrat-Ion-Resonance-2D" von Ben Mills-eigene Arbeit, (Public Domain) über Commons Wikimedia
2.”Nitrite-Ion-kanonische Strukturen” von Nothingserious-eigene Arbeit, (Public Domain) über Commons Wikimedia


