Unterschied zwischen Ammoniak und Ammoniumnitrat
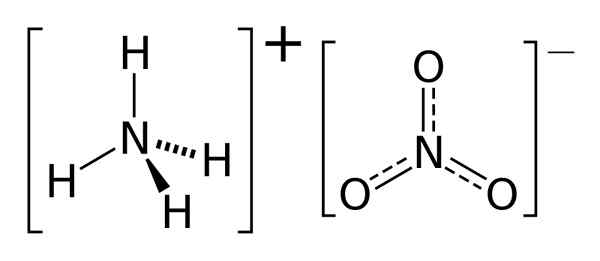
Der Schlüsselunterschied Zwischen Ammoniak und Ammoniumnitrat ist das Ammoniak ist eine gasförmige Verbindung, während Ammoniumnitrat eine feste Verbindung bei Raumtemperatur und Druck ist.
Sowohl Ammoniak als auch Ammoniumnitrat sind stickstoffhaltige Verbindungen. Es gibt jedoch Unterschiede zwischen Ammoniak und Ammoniumnitrat in ihrer chemischen Struktur, Aussehen und Eigenschaften. Wir werden die Hauptunterschiede zwischen Ammoniak und Ammoniumnitrat in diesem Artikel diskutieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ammoniak
3. Was ist Ammoniumnitrat
4. Seite an Seitenvergleich - Ammoniak gegen Ammoniumnitrat in tabellarischer Form
5. Zusammenfassung
Was ist Ammoniak?
Ammoniak ist eine anorganische chemische Verbindung mit der chemischen Formel NH3. Es existiert im gasförmigen Zustand bei Raumtemperatur und Druck. Daher ist es farblos und hat einen scharfen, irritierenden Geruch. Darüber hinaus wird es häufig als stickstoffhaltiges Abfall angesehen, hauptsächlich unter Wasserorganismen. Ebenso ist es eine alkalische Verbindung. Der IUPAC -Name der Verbindung ist Azane.
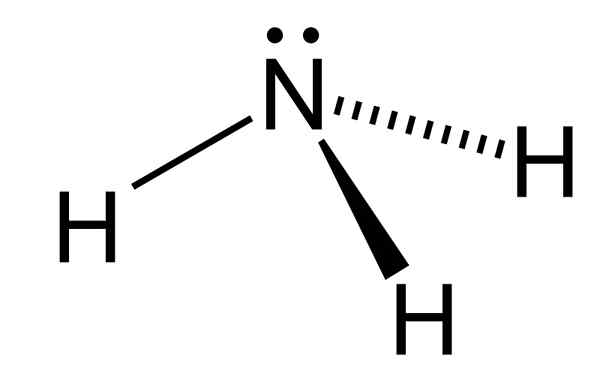
Abbildung 01: Chemische Struktur des Ammoniakmoleküls
Einige andere chemische Fakten über dieses Gas sind wie folgt:
- Molmasse ist 17.031 g/mol.
- Es ist ein farbloses Gas mit stechendem Geruch.
- Schmelzpunkt ist –77.73 ° C.
- Siedepunkt ist –33.34 ° C.
- Die molekulare Geometrie ist trigonal
- Es ist ein brennbares Gas.
Bei der Betrachtung der Geometrie des Ammoniakmolekül. Aufgrund des Vorhandensein. Da es N-H-Bindungen gibt, kann das Molekül Wasserstoffbrückenbindungen bilden. Darüber hinaus emittiert das kochende wässrige Ammoniak aufgrund seines niedrigen Siedepunkts leicht Ammoniakgas.
Was ist Ammoniumnitrat?
Ammoniumnitrat ist eine anorganische Verbindung mit der chemischen Formel NH4NEIN3. Es ist ein Salz, das Ammoniumkation und Nitratanion enthält. Ammoniumnitrat erscheint bei Raumtemperatur als weißer Feststoff und löst sich leicht in Wasser auf. Darüber hinaus tritt es als natürlicher Mineral der Natur auf.

Abbildung 02: Chemische Struktur von Ammoniumnitrat
Einige chemische Fakten über diese Verbindung sind wie folgt:
- Molmasse ist 80.043 g/mol.
- Erscheint als weißer oder grauer Feststoff.
- Schmelzpunkt ist 169.6 ° C.
- Über 210 ° C zersetzt es sich.
- Die Kristallstruktur der Verbindung ist trigonal.
Außerdem ist die Hauptverwendung dieser Verbindung in der Landwirtschaft, wie sie als Dünger mit hohem Stickstoff sehr nützlich ist. Abgesehen davon können wir es verwenden, um Sprengmischungen für Bergbau- und Steinbruchzwecke zu produzieren. Da die Auflösung dieser Verbindung in Wasser sehr endotherm ist, ist sie auch in einigen sofortigen kalten Packungen nützlich.
Was ist der Unterschied zwischen Ammoniak und Ammoniumnitrat?
Ammoniak ist eine anorganische chemische Verbindung mit der chemischen Formel NH3 Während Ammoniumnitrat eine anorganische Verbindung mit der chemischen Formel NH ist4NEIN3. Der Hauptunterschied zwischen Ammoniak und Ammoniumnitrat besteht darin, dass Ammoniak eine gasförmige Verbindung ist, während Ammoniumnitrat eine feste Verbindung bei Raumtemperatur und Druck ist. Abgesehen davon gibt es auch einen Unterschied zwischen Ammoniak und Ammoniumnitrat in ihrer Struktur. Das ist; Ammoniak ist ein trigonales pyramidales Molekül, während Ammoniumnitrat eine ionische Verbindung mit der trigonalen Kristallstruktur ist. Bei der Betrachtung der Anwendungen ist Ammoniak als Dünger, Vorläufer von stickstoffhaltigen Verbindungen, als Haushaltsreiniger, in der Fermentationsindustrie usw. nützlich. Während Ammoniumnitrat als Dünger und als Komponente in explosiven Gemischen nützlich ist.
Die folgende Infografik zum Unterschied zwischen Ammoniak und Ammoniumnitrat zeigt mehr Unterschiede in der tabellarischen Form.
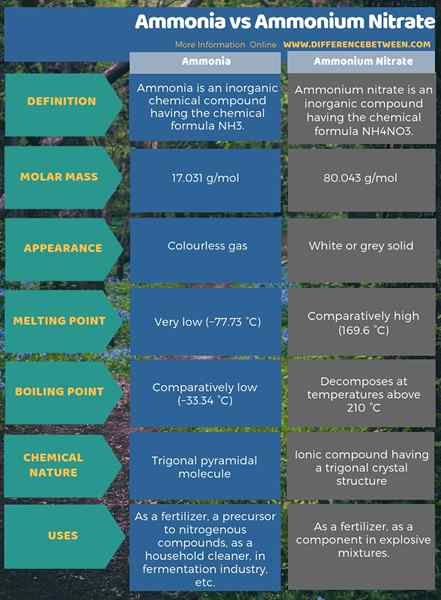
Zusammenfassung -Ammoniak gegen Ammoniumnitrat
Ammoniak und Ammoniumnitrat sind Stickstoffverbindungen, die Stickstoffatome in ihrer chemischen Struktur enthalten. Zusammenfassend ist der Hauptunterschied zwischen Ammoniak und Ammoniumnitrat darin, dass Ammoniak eine gasförmige Verbindung ist, während Ammoniumnitrat eine feste Verbindung bei Raumtemperatur und Druck ist.
Referenz:
1. "Ammoniumnitrat.Wikipedia, Wikimedia Foundation, 21. Oktober. 2018. Hier verfügbar
2. "Ammoniak.”Wikipedia, Wikimedia Foundation, 26. Oktober. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Ammoniak-2d” von Radio89-eigene Arbeit, (CC BY-SA 3.0) über Commons Wikimedia
2."Ammonium-nitrat-2d" von Mikayé (Public Domain) über Commons Wikimedia


