Unterschied zwischen Salpetersäure und Stacheläure
Der Schlüsselunterschied Zwischen Salpetersäure und Stachseläure ist das Salpetersäuremolekül enthält drei Sauerstoffatome, die an ein zentrales Stickstoffatom gebunden sind, während das Stallsäuremolekül zwei Sauerstoffatome enthält, die an ein zentrales Stickstoffatom gebunden sind.
Stickstoffsäuren sind Stickstoffsäuren. Beide Säuren enthalten Stickstoff, Sauerstoff und Wasserstoffatome.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Salpetersäure
3. Was ist Lalsensäure
4. Seite an Seite Vergleich - Salpetersäure gegen Sternchensäure in tabellarischer Form
5. Zusammenfassung
Was ist Salpetersäure?
Salpetersäure hat die chemische Formel HNO3. Es ist eine sehr ätzende und gefährliche Säure. Darüber hinaus kann es entweder eine verdünnte oder konzentrierte chemische Natur haben. In beiden Fällen hat es Salpetersäuremoleküle in Wasser gelöst. Die Reaktion zwischen Stickstoffdioxid und Wasser bildet Salpetersäure. Es gibt zwei Arten von Salpetersäure: saugere Salpetersäure und konzentrierte Salpetersäure.
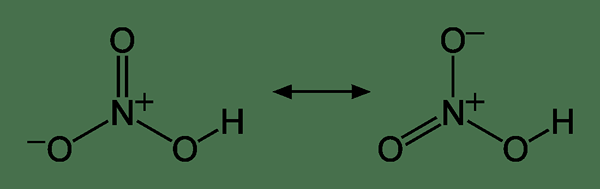
Abbildung 01: Resonanzstrukturen des Salpetersäuremoleküls
Raute Salpetersäure ist ein kommerzieller Grad von Salpetersäure, der eine sehr hohe Konzentration und eine hohe Dichte aufweist. Es enthält 90-99% HNO3. Wir können diese Flüssigkeit vorbereiten, indem wir Salpetersäure übermäßiges Stickstoffdioxid geben. Es bildet eine farblose, gelblich oder bräunlich -rauchende Flüssigkeit, die stark ätzend ist. Daher hat diese Säurelösung gasförmige Moleküle in Kombination mit Wasser; Es gibt kein Wasser darin. Das Rauch dieser Säure erhebt sich von der Oberfläche der Säure; Dies führt zu seinem Namen, "wütend". Die chemische Formel dieser Verbindung ist HNO3-xNEIN2.
Konzentrierte Salpetersäure ist einfach eine Lösung, die mehr Salpetersäure in weniger Wasser enthält. Das bedeutet. Im kommerziellen Maßstab werden 68% oder nach oben als konzentrierte Salpetersäure angesehen. Darüber hinaus beträgt die Dichte dieser Lösung 1.35 g/cm3. Diese viel Konzentration erzeugt keine Dämpfe, aber die sehr hohe Konzentration dieser Säure kann achkundige farbige Dämpfe ergeben. Wir können diese Flüssigkeit produzieren, indem wir Stickstoffdioxid mit Wasser reagieren.
Was ist Lalsensäure?
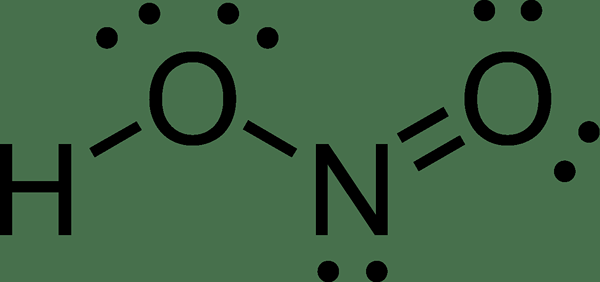
Lobsäure ist eine anorganische Säure mit der chemischen Formel HNO2. Es ist eine schwache Säure und eine monoprotische Säure. Diese Säure tritt im Lösungszustand, in der Gasphase und in Form von Nitrilsalz auf. Diese Säure ist nützlich, um Diazoniumsalze herzustellen, die Reagenzien bei Azo -Kopplungsreaktionen sind, um Azofarbstoffen zu ergeben.

Abbildung 02: Struktur von Lessrosensäure
Lösungsstuhllösungen erscheinen in hellblauer Farbe. Die konjugierte Base dieser Säure ist Nitrilion. In seiner Gasphase befindet sich Lessrosäure in der planaren Geometrie und kann sowohl cis- als auch transformen übernehmen. Das Trans -Isomer überwiegt bei Raumtemperatur und ist stabil als das CIS -Isomer.
Liegensäure kann durch die Ansäuerung wässriger Lösungen von Natriumnitrit mit einer Mineralsäure hergestellt werden. Wir können den Ansäuerungsprozess bei Eistemperaturen durchführen, und das HNO2 wird in situ -Bedingungen konsumiert. Freie Lessrous -Säuremoleküle sind instabil und neigen dazu, schnell zu zersetzen. Darüber hinaus können wir Lessungssäure produzieren, indem wir Dinitickstofftrioxid in Wasser auflösen.
Was ist der Unterschied zwischen Salpetersäure und Lachkrankheitsäure?
Salpetersäure und Salpetersäure sind Inorganinsäuren, die Stickstoffatome enthalten. Der Schlüsselunterschied zwischen Salpetersäure und Salpetersäure besteht darin, dass das Salpetersäuremolekül drei Sauerstoffatome enthält,.
Darüber hinaus besteht ein leicht identifizierbarer Unterschied zwischen Salpetersäure und Lustsäure darin, dass die Salpetersäure eine farblose, hellgelbe oder rote Flüssigkeit ist, während Salpeteräure eine blassblaue Farblösung ist. Darüber hinaus ist Salpetersäure eine starke Säure als Liegensäure.
Unten Infografik tabelliert die Unterschiede zwischen Salpetersäure und Lachensäure.
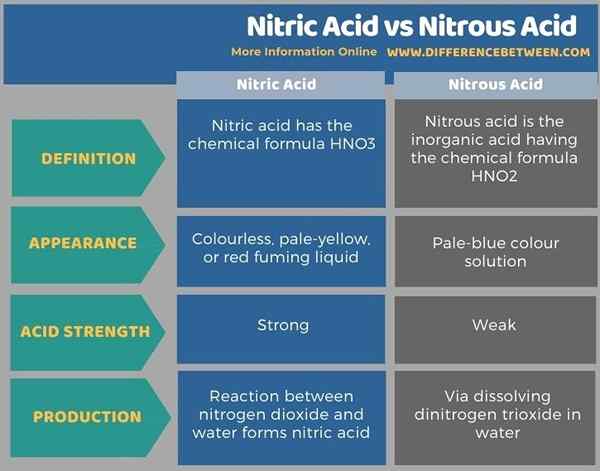
Zusammenfassung -Salpetersäure gegen Liegensäure
Salpetersäure und Salpetersäure sind Inorganinsäuren, die Stickstoffatome enthalten. Der Schlüsselunterschied zwischen Salpetersäure und Salpetersäure besteht darin, dass das Salpetersäuremolekül drei Sauerstoffatome enthält,.
Referenz:
1. Salpetersäure. (N.D.). Sciencedirect. Abgerufen am 13. Oktober 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Nöglichkeitsfaktor-Resonance-A" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Nitrous Säure ACSV" von Calvero - eigene Arbeit (Public Domain) über Commons Wikimedia


