Unterschied zwischen normalem Hämoglobin und Sichelzellen -Hämoglobin
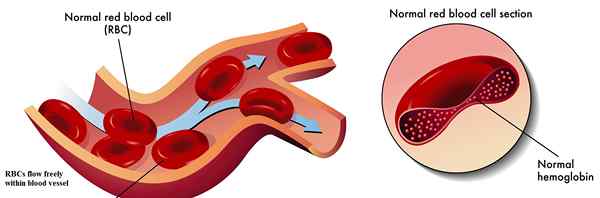
Schlüsselunterschied - normales Hämoglobin gegen Sichelzellen -Hämoglobin
Hämoglobin (HGB) ist das Hauptproteinmolekül. Das Hämoglobinmolekül besteht aus vier Sub -Protein -Molekülen, bei denen zwei Ketten Alpha -Globulin -Ketten sind und die anderen beiden Beta -Globulinketten sind. Eisenatome im Hämoglobin und die Form der roten Blutkörperchen sind für den Sauerstofftransport durch Blut wichtig. Wenn die Form des Hämoglobin zerstört wird, transportiert sie Sauerstoff nicht durch das Blut. Sichelzellen -Hämoglobin ist eine Art eines abnormalen Hämoglobinmoleküls. Der Schlüsselunterschied zwischen normalem Hämoglobin und Sichelzellen -Hämoglobin ist das Normales Hämoglobin hat Glutaminsäure in der 6th Position der Aminosäuresequenz der Beta -Globulinkette wohingegen Sichelzelle Hämoglobin hat Valin in der 6th Position der Beta -Globulinkette. Normale Hämoglobin- und Sichelzellen -Hämoglobin unterscheiden sich nur durch eine einzelne Aminosäure in Beta -Ketten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist normales Hämoglobin
3. Was ist Sichelzellen -Hämoglobin
4. Seite an Seitenvergleich - normales Hämoglobin gegen Sichelzellen -Hämoglobin
5. Zusammenfassung
Was ist normales Hämoglobin?
Hämoglobin ist ein eisenhaltiges Metalloprotein in roten Blutkörperchen. Es ist verantwortlich für den Transport von Sauerstoff aus der Lunge in die Körpergewebe und Organe und den Transport von Kohlendioxid aus Körpergeweben in die Lunge. Es ist auch als sauerstoffhaltiges Protein im Blut bekannt. Es ist ein komplexes Protein, das aus vier kleinen Proteinuntereinheiten und vier Hämgruppen besteht, die Eisenatome tragen, wie in Abbildung 01 gezeigt. Hämoglobin hat eine hohe Affinität zum Sauerstoff. In einem Hämoglobinmolekül befinden sich vier Sauerstoffbindungsstellen. Sobald Hämoglobin mit Sauerstoff gesättigt wird, wird das Blut hellrot in Farbe und ist als sauerstoffhaltiges Blut bekannt. Der zweite Zustand des Hämoglobins, dem Sauerstoff fehlt, ist als Desoxyhämoglobin bekannt. In diesem Zustand trägt Blut die dunkelrote Farbe.
In der Häm -Hämoglobin eingebettete Eisenatome erleichtert hauptsächlich den Sauerstoff- und Kohlendioxidtransport. Bindung von Sauerstoffmolekülen an Fe+2 Ionen verändern die Konformation des Hämoglobinmoleküls. Die Eisenatome im Hämoglobin tragen auch dazu bei, die typische Form der roten Blutkörperchen aufrechtzuerhalten. Daher ist Eisen ein lebenswichtiges Element in den roten Blutkörperchen.

Abbildung 01: normales Hämoglobin
Was ist Sichelzellen -Hämoglobin?
Sichelzellenanämie ist eine Blutkrankheit, die aufgrund abnormaler Hämoglobinproteine verursacht wird, die in den roten Blutkörperchen vorhanden sind. Sichelzellen -Hämoglobin ist eine Art abnormaler Hämoglobin, das in roten Blutkörperchen vorkommt. Sie sind auch als Hämoglobin S bekannt. Sie besitzen Sichel oder Halbmondformen. Sie werden als Ergebnis einer Sichelzellengenmutation produziert. Diese Mutation verändert eine einzelne Aminosäure in der Aminosäuresequenz von normalem Hämoglobin Beta -Kettenpeptid. Sichelzellen -Hämoglobin setzt sich auch aus zwei Alpha- und zwei Beta -Untereinheiten zusammen, genau wie normales Hämoglobin. Aufgrund der Mutation gibt es jedoch einen einzelnen Aminosäureunterschied in Beta -Untereinheiten. Im normalen Hämoglobin, 6th Die Position der Aminosäurekette in Beta -Ketten besteht aus Glutaminsäure. Im Sichelzellen -Hämoglobin 6 jedoch 6th Die Position wird von einer anderen Aminosäure namens Valine übernommen. Obwohl es sich um einen einzelnen Aminosäurer Unterschied handelt, ist es die Ursache für lebensbedrohliche Anämieerkrankungen, die als Sichelzellenerkrankung bezeichnet wird.
Wenn Valine bei 6 positioniert istth, Es führt dazu, dass die Beta -Kette einen Vorsprung bildet, der zu Beta -Ketten anderer Hämoglobinmoleküle passt. Diese Verbindungen machen Sichelzellen -Hämoglobin, sich gegenseitig zu aggregieren, ohne in der Lösung zu bleiben und Sauerstoff zu transportieren. Es erfordert eine starre Struktur und schließlich brechen rote Blutkörperchen vorzeitig zusammen, was zu Anämieerkrankungen führt.
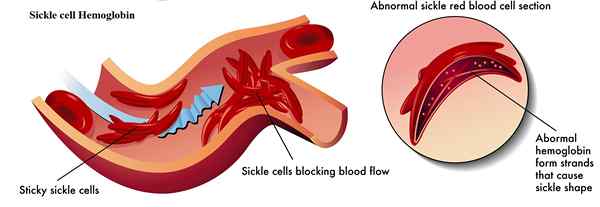
Abbildung 02: Sichelzellen -Hämoglobin
Was ist der Unterschied zwischen normalem Hämoglobin und Sichelzellen -Hämoglobin?
Normales Hämoglobin gegen Sichelzellen -Hämoglobin | |
| Normales Hämoglobin ist ein eisenhaltiges Protein in den roten Blutkörperchen, die Sauerstoff und Kohlendioxid durch das Blut transportieren. | Sichelzellen -Hämoglobin ist eine Art abnormaler Hämoglobin, das die Agglutination der Sichelform rote Blutkörperchen im Blut verursacht. |
| Abkürzung | |
| Abkürzung des normalen Hämoglobins ist HBA. | Abkürzung des Sichelzellen -Hämoglobins ist HBS. |
| Struktur | |
| Die Struktur des normalen Hämoglobins besteht aus zwei Alpha -Ketten und zwei Beta -Ketten. | Die Struktur von Sichelzellen -Hämoglobin besteht aus zwei Alpha -Ketten und zwei S -Ketten. |
| Form | |
| Normales Hämoglobin ist rund mit einem schmalen Zentrum. | Die Form der roten Blutkörperchen, die Sichelzellen -Hämoglobin enthält. |
| 6. Position der Aminosäure | |
| Die sechste Position in der Aminosäurekette der Beta -Globulinkette ist Glutaminsäure. | Die sechste Position wird von Valin in Sichelzellen -Hämoglobinen besetzt. |
| Ergebnis | |
| Normales Hämoglobin führt dazu, dass rote Blutkörperchen in Blutgefäßen frei fließen. | Sichelzellen -Hämoglobin veranlasst das Blockieren des Flusses roter Blutkörperchen in den Gefäßen. |
Zusammenfassung -normales Hämoglobin gegen Sichelzellen -Hämoglobin
Hämoglobin ist das Sauerstofftransportprotein in roten Blutkörperchen. Es besteht aus vier Untereinheiten von Proteinen namens Alpha und Beta -Ketten. Es ist ein eisenhaltiges Molekül, das die Farbe und die runde Form der roten Blutkörperchen verursacht. Aufgrund von Mutationen kann sich die Form der roten Blutkörperchen unterscheiden. Dies geschieht aufgrund abnormaler Hämoglobinmoleküle in den roten Blutkörperchen. Sichelzellen -Hämoglobin ist eine solche Mutation. Sie verändern die Form der roten Blutkörperchen von rund in die Sichelform, was letztendlich zu den vorzeitigen Zerstörungen der roten Blutkörperchen führt. Dieser Krankheitszustand ist als Sichelzellenanämie bekannt. Der Unterschied zwischen normalem Hämoglobin und Sichelzellen -Hämoglobin ist jedoch ein einzelner Aminosäurer Unterschied in der Beta -Kette des Hämoglobins.
Referenz:
1. Die molekulare Biologie der Sichelzellenanämie. N.P., N.D. Netz. 28. Mai 2017. .
2. „Sichelzellenerkrankung - Genetik zu Hause Referenz.”U.S. Nationalbibliothek für Medizin. Nationale Gesundheitsinstitute, n.D. Netz. 28. Mai 2017.
Bild mit freundlicher Genehmigung:
1. "Risiko-Faktoren-für-Slipple-Cell-Anämie (1) 2" von Diana Grib-eigene Arbeit (CC BY-SA 4.0) über Commons Wikimedia [Cropped]


