Unterschied zwischen Oxidation und Reduktion
Der Schlüsselunterschied Zwischen Oxidation und Reduktion ist das Die Oxidation bezieht sich auf den Elektronenverlust, während die Reduzierung auf den Gewinn von Elektronen bezieht.
Chemische Reaktionen zwischen verschiedenen Verbindungen werden als Redoxreaktionen bezeichnet, wenn sich die Oxidationszustände der Reaktanten von denen der Produkte unterscheiden. Redox ist kurz für die Reduktionsoxidation, was bei jeder chemischen Reaktion auftritt. Während Oxidationen auf den Elektronenverlust beziehen. Diese Reaktionen können je nach Prozess und den beteiligten Atomen einfach oder komplex sein.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Oxidation
3. Was ist Reduktion
4. Seite für Seitenvergleich - Oxidation gegenüber Verringerung der tabellarischen Form
5. Zusammenfassung
Was ist Oxidation?
Oxidation kann als Zunahme der Oxidationszahl beschrieben werden. Daher kann Oxidation als der Verlust von Elektronen aus einem Atom, Molekül oder einem Ion definiert werden. Dieser Elektronenverlust führt dazu, dass der Oxidationszustand der chemischen Spezies erhöht wird. Da eine Oxidationsreaktion Elektronen freigibt, sollte es eine elektronenakzeptante Spezies geben. Daher ist die Oxidationsreaktion eine halbe Reaktion einer Hauptreaktion. Die Oxidation einer chemischen Spezies wird als Änderung ihrer Oxidationszustände angegeben. Der Oxidationszustand ist eine Zahl mit einem positiven (+) oder negativen (-) Symbol, das den Verlust oder die Gewinne von Elektronen durch ein bestimmtes Atom, Molekül oder ein Ion angibt.

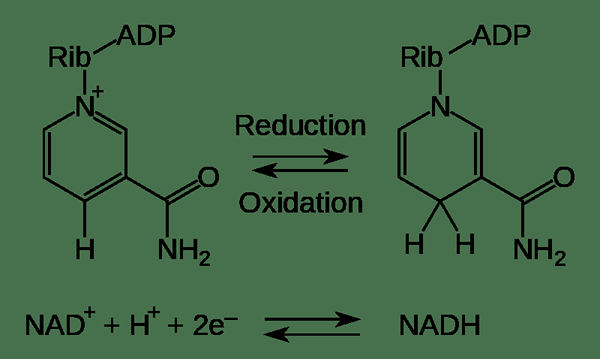
Abbildung 01: Ein Beispiel für die beiden Halbreaktionen: Oxidation und Reduktion
In der Vergangenheit erhielt der Begriff Oxidation die Definition „Die Zugabe von Sauerstoff zu einer Verbindung.Dies lag daran, dass Sauerstoff zu dieser Zeit das einzige bekannte Oxidationsmittel war. Diese Definition ist jedoch nicht mehr genau, da es in Abwesenheit von Sauerstoff viel mehr Oxidationsreaktionen gibt, die auftreten. Beispielsweise beinhaltet die Reaktion zwischen Magnesium (mg) und Salzsäure (HCl) keinen Sauerstoff, aber es handelt sich um eine Redoxreaktion, die die Oxidation von Mg in Mg umfasst2+.
Was ist Reduktion?
Die Reduktion kann als Abnahme der Oxidationszahl beschrieben werden. Daher können wir die Reduktion als den Gewinn von Elektronen aus einem Atom, einem Molekül oder einem Ion definieren. Dieser Elektronengewinn führt dazu, dass der Oxidationszustand der chemischen Spezies verringert wird. Da eine Reduktionsreaktion Elektronen erhält, sollte es eine elektronenspendende Spezies geben. Daher ist die Reduktionsreaktion eine halbe Reaktion einer Hauptreaktion. Die Verringerung einer chemischen Spezies wird als Änderung ihrer Oxidationszustände angegeben.
In der Vergangenheit erhielt der Begriff Reduktion die Definition „Die Entfernung von Sauerstoff aus einer Verbindung.Dies lag daran, dass Sauerstoff zu dieser Zeit das einzige bekannte Oxidationsmittel war. Diese Definition ist jedoch nicht mehr genau, da es in Abwesenheit von Sauerstoff viel mehr Oxidationsreaktionen gibt, die auftreten.
Was ist der Unterschied zwischen Oxidation und Reduktion?
Reduktion und Oxidation sind chemische Prozesse, die an jeder chemischen Reaktion beteiligt sind. Dies sind zwei entgegengesetzte Reaktionen. Der Hauptunterschied zwischen Oxidation und Reduktion besteht darin, dass die Oxidation auf den Elektronenverlust bezieht, während sich die Reduzierung auf den Gewinn von Elektronen bezieht. Während die Oxidation den Wert eines positiven (+) -Stypes erhöht, erhöht die Reduktion den Wert des negativen (-) Vorzeichens.
Zusammenfassung -Oxidation gegen Reduktion
Reduktion und Oxidation sind chemische Prozesse, die an jeder chemischen Reaktion beteiligt sind. Der Hauptunterschied zwischen Oxidation und Reduktion besteht darin, dass die Oxidation auf den Elektronenverlust bezieht, während sich die Reduzierung auf den Gewinn von Elektronen bezieht.
Referenz:
1. Helmenstine, Anne Marie. „Oxidationsdefinition und Beispiel in der Chemie.”Thoughtco, Februar. 12, 2020, hier erhältlich.
2. Helmenstine, Anne Marie. „Reduktionsdefinition in der Chemie.”Thoughtco, Februar. 11, 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "NAD -Oxidationsreduktion" von FVasconcellos 19:44, 9. Dezember 2007 (UTC). W: Bild: NAD -Oxidationsreduktion.PNG von Tim Vickers. - Vektorversion von W: Bild: NAD -Oxidationsreduktion.PNG von Tim Vickers (Public Domain) über Commons Wikimedia


