Unterschied zwischen Oxidationszahl und Ladung
Der Schlüsselunterschied Zwischen Oxidationszahl und Ladung ist das Wir können die Oxidationszahl eines Atoms unter Berücksichtigung der Anzahl des Elektrons bestimmen, das entweder entfernt oder durch das Atom gewonnen wird, während die Ladung unter Berücksichtigung der Gesamtzahl der Elektronen und Protonen im Atom bestimmt wird.
Verschiedene Elemente in der Periodenzüchtertabelle zeigen unterschiedliche chemische und physikalische Eigenschaften. Und wenn sie sich zu Molekülen verbinden, verbinden sich verschiedene Elemente mit anderen Elementen in verschiedenen Anteilen. Unter einer großen Anzahl von Variationen zwischen Elementen sind die einfachsten und wichtigsten Parameter ihre Ladung und Oxidationszahl. Ladung und die Oxidationszahl eines Elements helfen zu identifizieren, zu welcher Gruppe dieses Element in die Periodenzüchtertabelle gehört. Vor allem hilft es, die Fähigkeit des Elements zu beschreiben, andere Moleküle und Koordinationsverbindungen zu bilden, und hilft damit, ihre empirischen Formeln zu identifizieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Oxidationszahl
3. Was ist Gebühr?
4. Seite für Seitenvergleich - Oxidationsnummer gegen Ladung in tabellarischer Form
5. Zusammenfassung
Was ist Oxidationszahl?
Die Oxidationszahl ist ein Merkmal des zentralen Atoms einer Koordinationsverbindung. Es ist die Ladung des zentralen Atoms einer Koordinationsverbindung, wenn alle Bindungen um dieses Atom ionische Bindungen sind. Daher sind die Ladung und die Oxidationszahl manchmal ähnlich, aber manchmal anders. Zum Beispiel haben die einfachen S- und P -Blockelemente die gleiche Oxidationsnummer wie ihre Ladung. Auch polyatomare Ionen haben die gleiche Oxidationszahl wie die Ladung. Das gleiche chemische Element kann jedoch je nach anderen Atomen unterschiedliche Oxidationszahlen aufweisen. In einem freien Element ist die Oxidationszahl immer Null. Darüber hinaus weisen Übergangsmetallionen (D -Block) und Elemente unterschiedliche Oxidationszahlen auf.
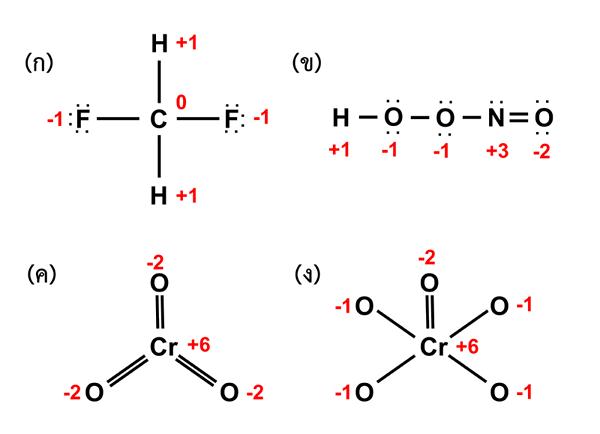
Abbildung 01: Bestimmung der Oxidationszahlen verschiedener Elemente in Verbindungen
Wenn Sie eine Koordinationsverbindung berücksichtigen, sollte das zentrale Metallatom immer leere Orbitale haben, denen die Liganden ihre einsamen Elektronenpaare und bildende Ionenbindungen spenden. Darüber hinaus können wir die Oxidationszahl des zentralen Metallatoms mit römischen Zahlen in Klammern bezeichnen. Wenn beispielsweise die Oxidationszahl von Metall „M“ 3 beträgt, schreiben wir sie als M (III).
Was ist Gebühr??
Die Ladung eines Atoms ist Null. Wenn Atome Elektronen entfernen oder gewinnen, erhalten sie eine elektrische Ladung. Das liegt daran. Atome entfernen oder gewinnen Elektronen, um ihre Valenzschale gemäß der Oktettregel zu füllen.
In einem Atom ist die Anzahl der Protonen und Elektronen gleich. Da Protonen eine positive Ladung haben und Elektronen eine negative Ladung haben, bildet das Atom ein positiv geladenes Ion, da die Anzahl der positiven Protonen höher ist als die Anzahl der Elektronen in diesem Ion.
Bestimmung der Ladung
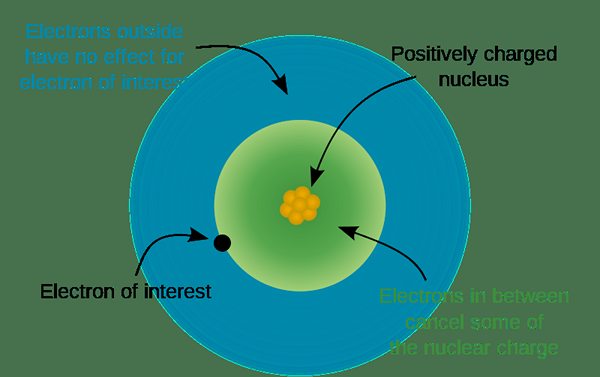
Wenn ein Atom elektronegativer ist, kann es auch Elektronen aus anderen Atomen zu sich selbst anziehen. Dort gewinnen sie mehr Elektronen als die Anzahl der Protonen in ihrem Kern. So werden die Atome zu negativen Ionen. Darüber hinaus unterscheidet sich die Anzahl der gespendeten oder abstrakten Elektronen von Atom zu Atom. Wir können dies aus der Position des Elements in der Periodenzüchttabelle vorhersagen. Normalerweise bilden die gleichen Gruppenatome dieselben geladenen Ionen, da sie die gleiche Anzahl von Valenzelektronen haben.

Abbildung 02: Struktur eines Atoms bei der Bestimmung der Ladung
Die Gruppennummer zeigt auch die Anzahl der Valenzelektronen; Daher können wir die Ladung der von den Atomen in dieser Gruppe gebildeten Ionen bestimmen. Zum Beispiel bilden die Elemente der Gruppe 1 monovalente Ionen mit +1 elektrische Ladung. Elemente der Gruppe zwei bilden zweifellos positiv geladene Ionen. Atome der Gruppe drei und Gruppe vier bilden +3 und +4 geladene Ionen entsprechend. Atome von Gruppe fünf bis Gruppe sieben machen negativ geladen. Daher machen Gruppe fünf Elemente -3 -geladene Ionen, während die Elemente der Gruppe 6 -2 Ionen und Elemente der Gruppe 7 -Ionen erzeugen. Abgesehen von diesen einfach geladenen Ionen gibt es auch komplexe Ionen mit Gebühren wie NH4+ und co32-usw.
Was ist der Unterschied zwischen Oxidationszahl und Ladung?
Oxidationsnummer und Ladung sind zwei verwandte Begriffe in der Chemie. Es gibt jedoch einige Unterschiede zwischen Oxidationszahl und Ladung. Der wichtigste Unterschied zwischen Oxidationszahl und Ladung besteht darin, dass wir die Oxidationszahl eines Atoms unter Berücksichtigung der Anzahl des Elektrons bestimmen können, das entweder entfernt oder von diesem Atom gewonnen wird, während die Ladung unter Berücksichtigung der Gesamtzahl der Elektronen und Protonen im Atom bestimmt wird.
Darüber hinaus kann es in Abhängigkeit von den umgebenden Atomen mehrere Oxidationszahlen für das gleiche chemische Element geben, während die Ladung des Atoms nur von der Anzahl der Elektronen und Protonen im Atom variabel ist. Daher ist dies ein weiterer wichtiger Unterschied zwischen Oxidationszahl und Ladung.

Zusammenfassung -Oxidationsnummer gegen Ladung
Ladungs- und Oxidationsnummer sind zwei verwandte Begriffe. Der Hauptunterschied zwischen Oxidationszahl und Ladung besteht darin, dass wir die Oxidationszahl eines Atoms unter Berücksichtigung der Anzahl der Elektronen bestimmen können, die entweder entfernt oder von diesem Atom gewonnen werden, während die Ladung unter Berücksichtigung der Gesamtzahl der Elektronen und Protonen im Atom bestimmt wird.
Referenz:
1. "Oxidationszahl." Übergangsmetalle. Hier verfügbar
2. Libretexten. "Das Atom.”Chemistry Libretexten, National Science Foundation, 26. November. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Oxidationszustandszuordnungen” von Saranphong Yimklan - eigene Arbeit (öffentlich zugänglich) über Commons Wikimedia
2."Effektive nukleare Ladung" durch eigene Arbeit - wirksame nukleare Ladung.GIF, (Public Domain) über Commons Wikimedia


