Unterschied zwischen Partikelmodell der Materie und der kinetischen Molekültheorie
Schlüsselunterschied - Partikelmodell der Materie gegenüber der kinetischen Molekültheorie
Partikelmodell der Materie ist ein Modell, das verwendet wird, um die Anordnung von Atomen, Molekülen oder Ionen zu erklären, die in jedem Material vorhanden sind. Die kinetische Molekulartheorie ist eine Theorie, die zur Erklärung der physikalischen Eigenschaften eines Gases verwendet wird. Der Schlüsselunterschied zwischen dem Partikelmodell der Materie und der kinetischen Molekültheorie ist das Das Partikelmodell der Materie beschreibt die Eigenschaften von festen, flüssigen und Gasphasen der Materie, während die kinetische Molekültheorie die Eigenschaften von Gasen beschreibt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Partikelmodell der Materie
3. Was ist die kinetische Molekulartheorie
4. Seite für Seitenvergleich - Partikelmodell der Materie gegen kinetische molekulare Theorie in tabellarischer Form
5. Zusammenfassung
Was ist Partikelmodell der Materie?
Partikelmodell der Materie ist ein Modell, das die Anordnung von Partikeln (Atomen, Molekülen oder Ionen) in einer bestimmten Phase der Materie erklärt. Es gibt drei Hauptphasen, die jede Materie in fester Phase, Flüssigphase und Gasphase bestehen kann. Das Partikelmodell drückt die folgenden Konzepte aus:
- Alle Materie werden aus kleinen Partikeln gebaut.
- Diese winzigen Partikel sind immer in Bewegung.
- Es gibt leere Räume zwischen diesen Partikeln.
- Wenn die Materie erhitzt wird, nimmt die Bewegung von Partikeln zu.
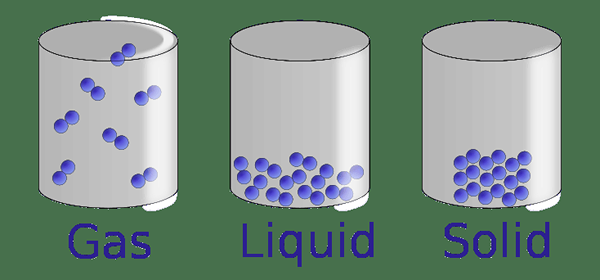
Abbildung 1: Die drei Phasen der Materie
Solide Phase
Die feste Phase ist die Phase der Materie, in der Partikel (Atome, Moleküle oder Ionen, aus denen der Feststoff besteht) festgehalten werden. Daher sind die Partikel sehr eng gepackt. Es gibt sehr winzige leere Räume zwischen den Partikeln. Es gibt sehr starke intermolekulare Wechselwirkungen zwischen Partikeln. Diese Merkmale verleihen Feststoffe eine bestimmte Form. Da die Partikel eng gepackt sind, weisen die Partikel eine fast vernachlässigbare Bewegung auf (Schwingungen können die meiste Zeit beobachtet werden; daher bleiben Partikel in bestimmten Positionen verbleiben). Da der Feststoff eine feste Form erhält, hat er auch ein festes Volumen. Die Dichte eines Feststoffs ist im Vergleich zu Flüssigkeiten und Gasen sehr hoch.
Flüssigphase
Die flüssige Phase ist eine Materiephase, in der Partikel eng zusammengepackt sind, aber keine enge Packung wie bei Festkörpern. Die leeren Räume zwischen Partikeln sind im Vergleich zu Festkörpern groß, aber im Vergleich zu Gasen gering. Partikel können sich frei bewegen. Die Flüssigkeit hat keine definierte Form; Es erhält die Form des Behälters, in dem die Flüssigkeit vorhanden ist. Die Dichte einer Flüssigkeit ist geringer als die eines festen und höheren als die eines Gases. Eine Flüssigkeit hat jedoch ein festes Volumen, da die Partikel eng zusammengepackt sind.
Gasphase
Die Gasphase ist eine Materiephase, in der sich Partikel in zufälligen Richtungen in kontinuierlicher Bewegung befinden. Daher gibt es große Räume zwischen Gaspartikeln. Diese Partikel füllen einen geschlossenen Behälter aus, in dem das Gas vorhanden ist. Dann erhält das Gas das Volumen des Behälters. Die Dichte eines Gases ist im Vergleich zu der von Festfallen und Flüssigkeiten sehr geringer.
Was ist die kinetische Molekulartheorie?
Die kinetische molekulare Theorie ist eine Theorie, die die physikalischen Eigenschaften von Gasen auf ihrer molekularen Ebene beschreibt. Die Konzepte der kinetischen Molekültheorie sind wie folgt.
- Gase enthalten Partikel, die in einer konstanten, zufälligen Bewegung sind.
- Diese Partikel kollidieren ständig miteinander. Die Kollisionen sind völlig elastisch.
- Das Volumen eines Gasmoleküls ist im Vergleich zum Volumen des Behälters, in dem das Gas vorhanden ist. Aber diese Partikel haben eine beträchtliche Masse.
- Es gibt keine intermolekularen Kräfte zwischen Gasmolekülen.
- Die durchschnittliche kinetische Energie des Gases ist proportional zur absoluten Temperatur des Gases.

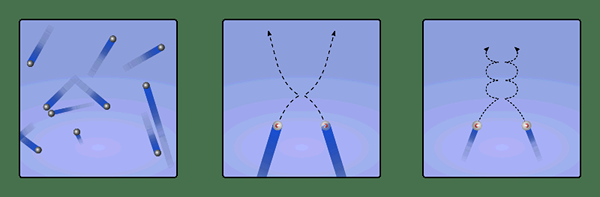
Abbildung 2: Reine Kollisionen zwischen Gaspartikeln
Die Beziehung zwischen der kinetischen Energie und der Geschwindigkeit von Gasmolekülen kann wie unten angegeben werden.
Ke = ½.MV2
Wo Ke die kinetische Energie ist, ist M die Masse eines Gasteilchens und V die durchschnittliche Geschwindigkeit von Gasmolekülen. Die Messung dieser Parameter ist jedoch schwierig; Somit wird die Gleichung wie unten modifiziert.
Ke = 3/2.kBT
Wo Ke die kinetische Energie ist, kB ist die Boltzmann -Konstante (1.381 × 10-23 M2 kg s-2 K-1), und t ist die absolute Temperatur des Gases (in Kelvin -Einheiten). Diese Gleichung zeigt, dass die kinetische Energie des Gases direkt proportional zur absoluten Temperatur des Gases ist.
Was ist der Unterschied zwischen dem Partikelmodell der Materie und der kinetischen Molekültheorie?
Partikelmodell der Materie gegen kinetische Molekültheorie | |
| Partikelmodell der Materie ist ein Modell, das die Anordnung von Partikeln (Atomen, Molekülen oder Ionen) in einer bestimmten Phase der Materie erklärt. | Die kinetische molekulare Theorie ist eine Theorie, die die physikalischen Eigenschaften von Gasen auf ihrer molekularen Ebene anzeigt. |
| Komponenten | |
| Das Partikelmodell der Materie beschreibt die Eigenschaften von festen, flüssigen und Gasphasen der Materie. | Die kinetische Molekularentheorie beschreibt die Eigenschaften von Gasen. |
| Inhalt | |
| Das Partikelmodell der Materie erklärt die Anordnung von Partikeln in einem Feststoff, Flüssigkeit oder Gas. | Die kinetische molekulare Theorie erklärt die Beziehung zwischen kinetischer Energie und anderen Eigenschaften eines Gases. |
Zusammenfassung - Partikelmodell der Materie gegen kinetische Molekültheorie
Das Partikelmodell und die kinetische molekulare Theorie erklären verschiedene physikalische Eigenschaften der Materie. Partikelmodell ist das Modell, das die Anordnung von Partikeln (Atomen, Molekülen oder Ionen) in einer bestimmten Phase der Materie erklärt. Die kinetische molekulare Theorie beschreibt die Beziehung zwischen kinetischer Energie und anderen Eigenschaften eines Gases. Der Schlüsselunterschied zwischen Partikelmodell der Materie und der kinetischen Molekültheorie besteht darin, dass das Partikelmodell der Materie die Eigenschaften von festen, flüssigen und Gasphasen der Materie beschreibt, während die kinetische Molekularentheorie die Eigenschaften von Gasen beschreibt.
Referenz:
1. „Partikelmodell von Festkörpern, Flüssigkeiten und Gasen.Chemstuff, 8. Juni 2012, hier erhältlich.
2. Baker, Rhys. „Was ist das Partikelmodell - eine Anleitung zu Festkörpern, Flüssigkeiten und Gasen.Owlcation, Owlcation, 14. Juni 2016, hier erhältlich.
3. Libretexten. „Kinetische Molekulare Theorie von Gasen.”Chemie -Libretexte, Libretexte, 2. Oktober. 2016, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Zustände der Materie en" von Yelod - Wikimedia Commons * yelod - Wikipedia (en) * ילוד - ויקיפד &stung העברית - eigenes Werk, (CC BY -SA 3.0) über Commons Wikimedia
2. „Kinetische Theorie der Gase (2)“ von Olivier Cleynen und Benutzer: Sharayanan - eigene Arbeit basierend auf der Datei: Kinetische Theorie der Gase.SVG (CC BY-SA 3.0) über Commons Wikimedia


