Unterschied zwischen prozentualer Häufigkeit und relativer Häufigkeit
Schlüsselunterschied - prozentuale Häufigkeit gegenüber relativer Häufigkeit
Prozentuale Häufigkeit und relative Häufigkeit sind prozentuale Werte chemischer Elemente, die ihr Auftreten in der Umwelt darstellen. Der Hauptunterschied zwischen prozentualer Häufigkeit und relativer Häufigkeit besteht darin Die prozentuale Häufigkeit ergibt die Fülle von Isotopen, während die relative Häufigkeit die Fülle chemischer Elemente ergibt. Die prozentuale Häufigkeit kann verwendet werden, um die durchschnittliche Atommasse eines bestimmten chemischen Elements zu bestimmen. Die relative Häufigkeit ergibt das Auftreten eines bestimmten chemischen Elements in einer bestimmten Umgebung, i.E, auf Erden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist prozentuale Häufigkeit
3. Was ist relative Fülle
4. Ähnlichkeiten zwischen prozentualer Häufigkeit und relativer Häufigkeit
5. Nebenseitiger Vergleich -prozentuale Häufigkeit gegenüber relativen Häufigkeit in tabellarischer Form
6. Zusammenfassung
Was ist prozentuale Häufigkeit?
Die prozentuale Häufigkeit ist die prozentuale Menge aller natürlich vorkommenden Isotope eines Elements. Isotope sind Atome desselben Elements mit identischen Atomzahlen, aber unterschiedlichen Massenzahlen. Dies bedeutet, dass Isotope Atome sind, die die gleiche Anzahl von Protonen im Atomkern haben, aber unterschiedliche Anzahl von Neutronen.
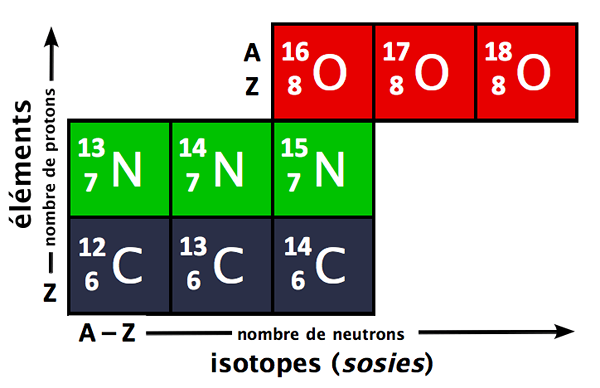
Abbildung 1: Isotope verschiedener Elemente können verwendet werden, um ihre durchschnittlichen Atommassen zu finden
Isotope jedes Elements treten natürlich in unterschiedlichen Verhältnissen auf. Die prozentuale Häufigkeit eines Isotops zeigt die Wahrscheinlichkeit, dass Isotopen in der Natur festgestellt werden, da Elemente als Mischung von Isotopen gefunden werden können. Die prozentuale Häufigkeit kann verwendet werden, um die Atommasse des Elements zu finden. Die Atommasse kann unter Verwendung der folgenden Gleichung gefunden werden.
Durchschnittliche Atommasse = ∑ (Masse der Isotope x Prozent Häufigkeit von Isotopen)
Betrachten wir ein Beispiel, um dies zu verstehen. Die stabilsten, natürlich vorkommenden Chlorisotope sind Cl-35 (Masse = 34.969 und prozentuale Häufigkeit = 75.53%) und Cl-37 (Masse = 36.966 und prozentuale Häufigkeit = 24.47%). Dann,
Die durchschnittliche Masse von Chlor = ∑ (Masse der Isotope x prozentig Häufigkeit von Isotopen)
= ∑ (34.969 x 75.53/100) + (36.966 x 24.47/100)
= 26.412 AMU + 9.045 Amu
= 35.46 Amu.
Was ist relative Fülle?
Die relative Häufigkeit eines Elements ist ein Maß für das Auftreten eines Elements im Vergleich zu allen anderen Elementen in der Umwelt. Es gibt drei Möglichkeiten, die relative Häufigkeit eines Elements zu bestimmen:
- Massenanteil
- Maulwurfsfraktion
- Volumenanteil
Die Volumenfraktionsmethode ist am häufigsten für gasförmige Elemente in Gasmischungen, i.E, die Atmosphäre der Erde. Die meisten relativen Häufigkeitsausdrücke sind jedoch Massenfraktionen.

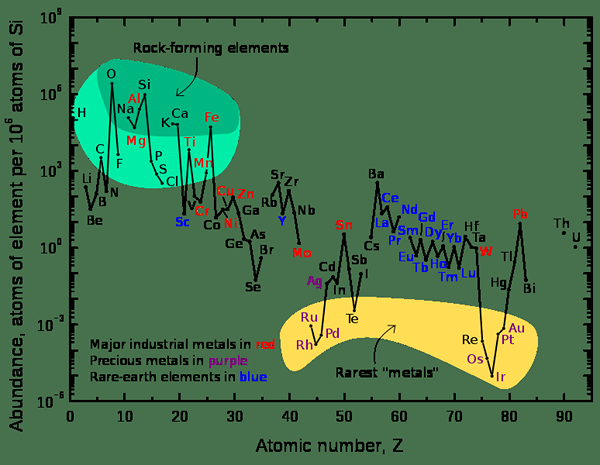
Abbildung 2: Ein Diagramm, das die relative Fülle von Elementen in der Oberkruste der Erde zeigt
Bei der Betrachtung des Universums sind die am häufigsten vorkommenden chemischen Elemente Wasserstoff und Helium. Bei der Betrachtung der Erde ist das häufigste Element Eisen, dessen Massenprozentsatz 32 beträgt.1%. Andere Elemente sind Sauerstoff (32.1%), Silikon (15.1%), Magnesium (13.9%), Schwefel (2.9%) und andere Elemente sind in den Spurenprozentsätzen vorhanden.
Was sind die Ähnlichkeiten zwischen prozentualer Häufigkeit und relativer Häufigkeit?
- Sowohl prozentuale Häufigkeit als auch relative Häufigkeit sind Prozentwerte.
- Sowohl prozentuale Häufigkeit als auch relative Häufigkeit drücken die Prozentsätze verschiedener chemischer Elemente aus.
Was ist der Unterschied zwischen prozentualer Häufigkeit und relativer Häufigkeit?
Prozentuale Häufigkeit gegenüber der relativen Häufigkeit | |
| Die prozentuale Häufigkeit ist die prozentuale Menge aller natürlich vorkommenden Isotope eines Elements. | Die relative Häufigkeit eines Elements ist ein Prozentsatz des Auftretens eines Elements im Vergleich zu allen anderen Elementen in der Umwelt. |
| Darstellung | |
| Die prozentuale Häufigkeit ergibt die Fülle von Isotopen. | Die relative Häufigkeit ergibt die Fülle chemischer Elemente. |
Zusammenfassung -prozentuale Häufigkeit gegenüber relativer Häufigkeit
Die prozentuale Häufigkeit und die relative Häufigkeit sind zwei Begriffe, die zur Fülle von Isotopen und chemischen Elementen verwendet werden. Der Hauptunterschied zwischen prozentualer Häufigkeit und relativer Häufigkeit besteht darin.
Referenz:
1. „Durchschnittliche Atommasse.”Durchschnittliche Atommasse, [E -Mail geschützt], hier verfügbar.
2. „Fülle der chemischen Elemente.”Wikipedia, Wikimedia Foundation, 25. Februar. 2018, hier erhältlich.
3. Simoes, Christ. „Fülle der chemischen Elemente.”Astrono, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Isotope CNO" von Lucquessoy - eigener Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "Elementarhäufigkeiten" von Gordon B. Haxel, Sara Boore und Susan Mayfield von USGS; Vektorisiert von Benutzer: Michbich - (Public Domain) über Commons Wikimedia


