Differenz zwischen Phasendiagramm und Gleichgewichtsdiagramm
Schlüsselunterschied - Phasendiagramm gegen Gleichgewichtsdiagramm
Phasendiagramme oder Gleichgewichtsdiagramme sind Diagramme oder Diagramme, die die Beziehung zwischen Temperatur, Druck und Zusammensetzung eines Systems zeigen. Diese Diagramme geben Details zu den Bedingungen thermodynamisch unterschiedlicher Phasen an, die im Gleichgewicht miteinander koexistieren. Eine Phase ist ein homogener Teil eines Systems mit gleichmäßigen chemischen und physikalischen Eigenschaften. Es gibt drei Hauptphasen, die eine Substanz existieren kann: Fest-, Flüssigkeits- und Gasphase. Es gibt keinen Unterschied zwischen Phasendiagramm und Gleichgewichtsdiagramm.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein Phasendiagramm
3. Was ist ein Gleichgewichtsdiagramm
4. Phasendiagramm gegen Gleichgewichtsdiagramm
5. Zusammenfassung
Was ist ein Phasendiagramm?
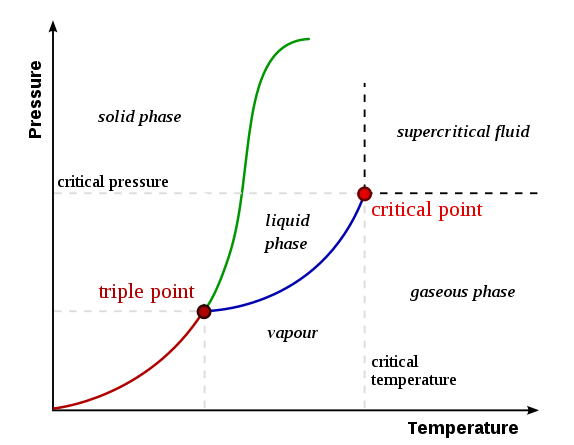
Ein Phasendiagramm ist ein Diagramm, das die Details zu den Bedingungen thermodynamisch unterschiedlicher Systeme zusammenfasst. Ein Phasendiagramm zeigt Phasengrenzen oder Gleichgewichtsgrenzen, die Phasen voneinander trennen. Das Phasendiagramm ist ein Druckdruck gegen Temperatur.

Abbildung 1: Ein Phasendiagramm mit Grenzlinien, dreifacher Punkt und kritischem Punkt
Wichtige Komponenten eines Phasendiagramms
Einige wichtige Komponenten in einem Phasendiagramm umfassen die Followings:
- Phasengrenzen (Gleichgewichtsgrenzen) - Die Linien in einem Phasendiagramm, die zwei Phasen trennen; Jede Phase, die sich im Gleichgewicht mit einer anderen Phase befindet.
- Dreifacher Punkt - ein Punkt, an dem sich die Gleichgewichtslinie kreuzt. Ein dreifacher Punkt zeigt die Bedingungen eines Systems an, das eine Substanz aufweist, die in allen drei Materiephasen koexistieren kann (Feststoff, Flüssigkeit und Gas).
- Kritischer Punkt - Die Temperatur und der Druck, bei dem sich diese Substanz gleichzeitig als Gas und Flüssigkeit verhalten kann; Es treten ununterscheidbare Gas- und Flüssigphasen auf. Daher gibt es keine Phasengrenzen. Kritischer Punkt ist der Endpunkt der Kurve in der Phase
- Fusionskurve (Schmelz- oder Gefrierkurven) - Die Grenzlinie in einem Phasendiagramm, das die Bedingungen für die Phasenübergänge zwischen der Gasphase und der flüssigen Phase zeigt (blau gefärbte Linie im obigen Diagramm).
- Verdampfungskurve (oder Kondensationskurve) - Die Grenzlinie in einem Phasendiagramm, das die Bedingungen für die Phasenübergänge zwischen fester Phase und flüssiger Phase zeigt (grüne Linie in der obigen Diagramm).
- Sublimationskurve - Die Grenzlinie in einem Phasendiagramm, das die Bedingungen für die Phasenübergänge zwischen der festen Phase und der Gasphase zeigt (rote Farblinie im obigen Phasendiagramm).
Hier ist Fusion das Schmelzen oder Einfrieren, das den Phasenübergang zwischen Gasphase und Flüssigkeitsphase umfasst. Die Verdampfung ist die Umwandlung einer Flüssigkeit in die Dampfphase (Gasphase), während Kondensation die Umwandlung eines Dampfs in Flüssigkeit ist. Sublimation ist die Umwandlung eines Feststoffs direkt in die Gasphase, ohne eine flüssige Phase zu durchlaufen.
Arten von Phasendiagramm
Es gibt nur wenige Arten von Phasendiagrammen.
Unary Phasendiagramme
Dies sind die einfachste Form von Phasendiagrammen. Diese Diagramme zeigen die drei Phasen einer Substanz, die von den Gleichgewichtsgrenzen getrennt sind (wie in Abbildung 1).
Binärphasendiagramme
Ein binäres Phasendiagramm zeigt das Gleichgewicht zwischen zwei im selben System existierenden Substanzen. In den meisten Fällen bleibt der Druck gleich und die Variablen sind Temperatur und die Substanzenzusammensetzungen. Hier können die beiden Substanzen Metalle, ein Metall und eine Verbindung oder zwei Verbindungen sein.
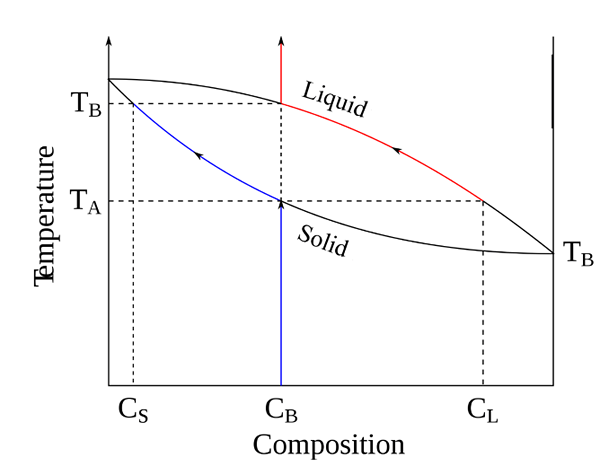
Abbildung 2: ein Binärphasendiagramm
Was ist ein Gleichgewichtsdiagramm?
Ein Gleichgewichtsdiagramm ist ein Diagramm, das das Gleichgewicht zwischen Phasen einer Substanz zeigt, die in einem geschlossenen System koexistiert. Es ist auch als Phasendiagramm bekannt.
Was ist der Unterschied zwischen Phasendiagramm und Gleichgewichtsdiagramm?
- Es gibt keinen Unterschied zwischen Phasendiagramm und Gleichgewichtsdiagramm, da es sich um Synonyme handelt. Beide Begriffe beziehen sich auf das Diagramm, das die Details zu den Bedingungen thermodynamisch unterschiedlicher Systeme zusammenfasst.
Zusammenfassung -Phasendiagramm gegen Gleichgewichtsdiagramm
Eine Phase ist ein homogener Teil eines Systems mit gleichmäßigen chemischen und physikalischen Eigenschaften. Es gibt drei Hauptphasen, die jede Substanz existieren kann: feste Phase, flüssige Phase und Gasphase. Ein Phasendiagramm ist ein Diagramm, das das Gleichgewicht darstellt. Dieses Diagramm wird auch als Gleichgewichtsdiagramm bezeichnet, da es Gleichgewicht zeigt.
Referenz:
1. „Gleichgewichtsdiagramm.Das kostenlose Wörterbuch, Farlex, hier erhältlich.
2. Libretexten. „Phasendiagramme.”Chemie libretexten, libretexten, 6. Februar. 2018, hier erhältlich.
3. „Flüssigkeiten.Phasendiagramme, chemiert.Chem. Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Phase-diag2" von Matthieumarechal (CC BY-SA 3.0) über Commons Wikimedia [modifiziert]
2. "Partielles Schmelzphasendiagramm" durch Verfestigung_1er_cristal.SVG: Cdangderivative Arbeit: Fitzgabbro (Diskussion) - Verfestigung_1er_cristal.SVG (CC BY-SA 3.0) über Commons Wikimedia [modifiziert]


