Unterschied zwischen Natriumchlorit und Natriumhypochlorit

Schlüsselunterschied - Natriumchlorit gegen Natriumhypochlorit
Natriumchlorit und Natriumhypochlorit sind übliche Natriumsalze, die in der Branche verwendet werden. Beide Verbindungen sind sehr wichtig als Bleichmittel und Desinfektionsmittel. Sie unterscheiden sich jedoch sehr voneinander, wenn ihre chemischen Eigenschaften wie Molmasse und physikalische Eigenschaften berücksichtigt werden. Natriumchlorit wird hauptsächlich in der Papierherstellung und als Desinfektionsmittel eingesetzt. Natriumhypochlorit wird als Desinfektionsmittel verwendet, indem es in Wasser gelöst wird, um „flüssiges Bleichmittel“ zu bilden. Der Schlüsselunterschied zwischen Natriumchlorit und Natriumhypochlorit ist das Natriumchlorit enthält Chloratome mit +3 Oxidationszustand Während Natriumhypochlorit Chloratome mit einem Oxidationszustand von +1 enthält.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Natriumchlorit?
3. Was ist Natriumhypochlorit?
4. Ähnlichkeiten zwischen Natriumchlorit und Natriumhypochlorit
5. Seite für Seitenvergleich - Natriumchlorit gegen Natriumhypochlorit in tabellarischer Form
6. Zusammenfassung
Was ist Natriumchlorit??
Natriumchlorit ist eine anorganische chemische Verbindung mit der chemischen Formel NaClo2. Die Molmasse dieser Verbindung beträgt 90.438 g/mol, wenn es wasserfrei ist. Es gibt auch eine Hydratform (besteht aus drei Wassermolekülen, die mit dem Natriumchloritmolekül assoziiert sind, dessen Molmasse 144 beträgt.48 g/mol). Die Verbindung wird auch Chlorsäure bezeichnet. Es ist eine ionische Verbindung, die ein Natriumkation enthält (Na+) und Chloritanion (Clo2-).

Abbildung 1: Eine mit Natriumchlorit gefüllte Flasche
Es ist als weißes kristallines Pulver erhältlich, das geruchlos ist. Das Verbrennen von Natriumchlorit ist schwierig, kann aber das Verbrennen organischer Verbindungen beschleunigen. Daher kann Natriumchlorit verwendet werden, um explosive Gemische mit brennbaren Materialien herzustellen. Natriumchlorit zersetzt sich bei ca. 180-200 ° C.
Natriumchlorit ist in Wasser weniger löslich, aber in Methanol und Ethanol löslicher. Die Kristallstruktur der Verbindung ist monoklinisch. Natriumchlorit wird hauptsächlich bei der Herstellung von Papier und auch als Desinfektionsmittel verwendet. Es ist ein gutes Oxidationsmittel; Daher wird verschiedene Arten von Materialien wie Holz, Öle usw. gebleicht, usw.
Die freie Chlorsäure (HCLO2) ist sehr instabil und hat in der Branche keine beträchtliche Bedeutung. Aber das Natriumsalz dieser Säure ist sehr stabil und auch kostengünstig. Meistens wird Natriumchlorit aus Natriumchlorat abgeleitet, das die chemische Formel NaClo hat3. Der Produktionsprozess ist eine indirekte Methode, bei der Chlordioxid (CLO2) wird zunächst produziert. Chlordioxid ist sehr explosiv und wird durch Reduzieren von Natriumchlorat in einer starken Säure in Gegenwart eines Reduktionsmittels wie Natriumsulfit hergestellt. Das produzierte Chlordioxid wird dann zusammen mit einer Reduktion durch Wasserstoffperoxid (H) in eine alkalische Lösung absorbiert2Ö2). Dies ergibt Natriumchlorit.
Was ist Natriumhypochlorit??
Natriumhypochlorit ist eine anorganische Verbindung mit der chemischen Formel NaClo. Das Atomverhältnis zwischen Natrium, Chlor und Sauerstoff beträgt 1: 1: 1. Die Verbindung besteht aus einem Natriumkation, das an einen Hypochloritanion gebunden ist. Daher ist es das Natriumsalz der hypochlorischen Säure. Wenn Natriumhypochlorit in Wasser gelöst ist, ist es aufgrund seiner Bleicheigenschaften als flüssiges Bleichmittel bekannt.
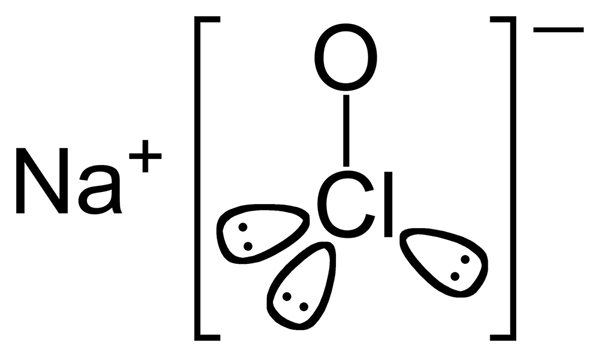
Abbildung 2: Chemische Struktur von Natriumhypochlorit
Die Molmasse von Natriumhypochlorit beträgt 74.44 g/mol. Das Erscheinungsbild dieser Verbindung kann als grünlich gelbem Feststoff beschrieben werden. Es hat auch einen süßen Geruch. Der Schmelzpunkt von Natriumhypochlorit beträgt 18 ° C und der Siedepunkt 101 ° C beträgt.
Natriumhypochlorit wird hauptsächlich als Desinfektionsmittel und als Bleichmittel verwendet. Fast die gesamte Bleichflüssigkeit, die wir im Haushalt verwenden, enthalten rund 3-8% Natriumhypochlorit. Diese Verbindung hat Entlastungseigenschaften; Daher wird es verwendet, um Schimmelpilzflecken, Zahnflecken usw. zu entfernen. Natriumhypochlorit ist ein gutes Desinfektionsmittel, da es eine breite Palette an antimikrobieller Aktivität aufweist.
Die Produktion von Natriumhypochlorit erfolgt über einen Hooker -Prozess. Es ist eine großflächige industrielle Methode. Hier wird Natriumhypochlorit hergestellt, indem Chlorgas in eine kalte, verdünnte Natriumhydroxidlösung geleitet wird. Das andere Produkt, das mit dieser Methode angegeben ist, ist Natriumchlorid (NaCl).
Was sind die Ähnlichkeiten zwischen Natriumchlorit und Natriumhypochlorit?
- Natriumchlorit und Natriumhypochlorit bestehen aus Na-, CL- und O -Atomen.
- Beide sind gute Desinfektionsmittel.
Was ist der Unterschied zwischen Natriumchlorit und Natriumhypochlorit?
Natriumchlorit gegen Natriumhypochlorit | |
| Natriumchlorit ist eine anorganische chemische Verbindung mit der chemischen Formel NaClo2. | Natriumhypochlorit ist eine anorganische Verbindung mit der chemischen Formel NaClo. |
| Atomizität | |
| Natriumchlorit hat ein Natriumatom, ein Chloratom und zwei Sauerstoffatome. | Natriumhypochlorit hat ein Natriumatom, ein Chloratom und ein Sauerstoffatom. |
| Oxidationszustand von Chlor | |
| Der Oxidationszustand von Chlor in Natriumchlorit beträgt +3. | Der Oxidationszustand von Chlor in Natriumhypochlorit beträgt +1. |
| Aussehen | |
| Natriumchlorit ist ein weißes kristallines Pulver. | Natriumhypochlorit ist ein grünlich-gelbes Feststoff. |
| Geruch | |
| Natriumchlorit ist geruchlos. | Natriumhypochlorit hat einen süßen Geruch. |
| Molmasse | |
| Die Molmasse von Natriumchlorit beträgt 90.438 g/mol. | Die Molmasse von Natriumhypochlorit beträgt 74.44 g/mol. |
| Schmelzpunkt und Siedepunkt | |
| Natriumchlorit zersetzt sich bei ca. 180-200 ° C. | Der Schmelzpunkt ist 18 ° C und der Siedepunkt 101 ° C beträgt. |
| Elternverbindung | |
| Natriumchlorit ist ein Natriumsalz aus Chlorsäure. | Natriumhypochlorit ist ein Natriumsalz aus hypochlorischer Säure. |
| Produktion | |
| Natriumchlorit wird indirekt aus Natriumchlorat hergestellt. | Natriumhypochlorit wird aus dem Hooker -Prozess erzeugt. |
Zusammenfassung -Natriumchlorit gegen Natriumhypochlorit
Natriumchlorit ist Naclo2 und Natriumhypochlorit ist Naclo. Der Schlüsselunterschied zwischen Natriumchlorit und Natriumhypochlorit besteht darin.
Referenz:
1. "Natriumhypochlorit.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. National Library of Medicine, hier verfügbar.
2. Croswell, Jonathan. „Was ist Natriumchlorit??”Livestrong.Com, Blattgruppe, 3. Oktober. 2017, hier erhältlich.
3. "Natriumhypochlorit.”Wikipedia, Wikimedia Foundation, 17. Februar. 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Natriumchlorit 450g" von W. Oelen -(CC BY -SA 3.0) über Commons Wikimedia
2. "Natrium-Hypochlorit" von Benjah-BMM27-eigene Arbeit (Public Domain) über Commons Wikimedia


