Unterschied zwischen PKA und PKB
Schlüsselunterschied - PKA gegen PKB
PKA und PKB sind häufige Begriffe in der Chemie, die als Dissoziationskonstanten bekannt sind. PKA ist Säure -Dissoziationskonstante, und PKB ist Basisdissoziationskonstante. Diese Begriffe werden verwendet, um es einfach zu machen, mit sehr großen oder sehr kleinen Werten zu arbeiten. Das "P" in diesen Begriffen steht für "negatives Logarithmus". Der Schlüsselunterschied Zwischen PKA und PKB ist das PKA ist der negative Logarithmus von Ka, während PKB der negative Logarithmus von KB ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist PKA
3. Was ist PKB
4. Beziehung zwischen PKA und PKB
5. Seite an Seite Vergleich - PKA gegen PKB in tabellarischer Form
6. Zusammenfassung
Was ist PKA?
PKA ist der negative Logarithmus von Ka. Ka ist die Säure -Dissoziationskonstante einer Lösung. Es ist eine quantitative Messung der Stärke einer Säure in einer Lösung. Säuren sind chemische Verbindungen, die ein oder mehrere Wasserstoffionen (Protonen) in eine Lösung freisetzen können. Wenn die Säure -Dissoziationskonstante; Ka ist höher, es bedeutet, dass Säure vollständig (oder fast vollständig) in Ionen dissoziiert wird, die Wasserstoffionen bilden. Dann zeigt es an, dass Säure eine starke Säure ist. Da die PKA der negative logarithmische Wert von KA ist, ist PKA ein kleinerer Wert für starke Säure.
pka = -log10KA
Senken Sie die PKA -Vlauer, desto stärker ist die Säure. In ähnlicher Weise ist der PKA -Wert höher, desto schwächer ist die Säure. Durch Betrachtung der PKA -Werte verschiedener Säuren kann man die relativen Säurestärken vergleichen. Anstatt KA -Werte zu verwenden, werden die PKA -Werte gemeinsam verwendet, da es einfacher ist, mit sehr großen oder sehr kleinen Zahlen mit kleinen Dezimalstellen zu arbeiten.

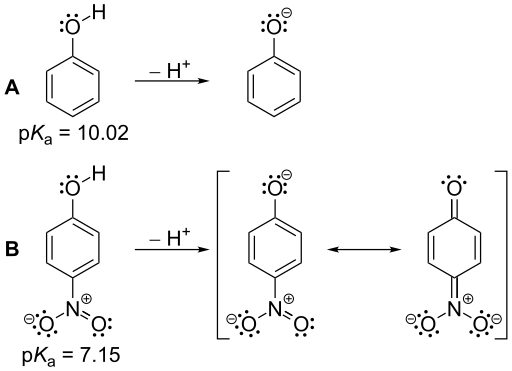
Abbildung 01: Die PKA -Werte von Phenol und Nitrophenol: Nitrophenol ist eine stärkere Säure als Phenol aufgrund seines kleineren PKA -Wertes im Vergleich zu Nitrophenol.
Neben dem Vergleich der Säurefestigkeit werden PKA -Werte auch verwendet, um geeignete Puffer auszuwählen. Nach der Henderson-Hasselbalch-Gleichung besteht eine Beziehung zwischen pH und PKA eines Systems.
PH = PKA + Protokoll10([A-]/[AH])
für die Dissoziation von HA -Säure. Diese Gleichung kann wie unten wieder geschrieben werden.
KA/[H+] = [A-]/[AH]
Nach dieser Gleichung sind die PKA- und pH -Werte desselben Systems gleich, wenn die Hälfte der Säure dissoziiert wurde. Da die Pufferkapazität eines Systems seine Fähigkeit ist, den pH -Wert einer Lösung aufrechtzuerhalten, sollte der Puffer ausgewählt werden, in dem PKA und pH sehr nahe beieinander liegen.
Was ist PKB?
PKB ist der negative Logarithmus von KB. KB ist die Basisdissoziationskonstante. Es wird verwendet, um die Stärke einer Basis quantitativ zu bestimmen. Wenn eine Basis in Wasser gelöst ist, dissoziiert sie in Ionen, die eine grundlegende Lösung bilden. Starke Basen dissoziieren vollständig. Schwache Basen dissoziieren teilweise.
pkb = -log10KB
Das "P" in PKB steht für "negatives Logarithmus". Da die meisten KB -Werte sehr groß oder sehr klein sind, werden negative Logarithmen dieser Werte verwendet, um es einfach zu machen, damit umzugehen. Daher kann ein großer KB -Wert durch einen kleinen PKB -Wert mit kleinen Dezimalstellen gekennzeichnet werden.
Wie ist die Beziehung zwischen PKA und PKB?
Die Beziehung zwischen KA und KB ist wie unten angegeben.
Kw = ka.KB
Dann wird die Beziehung zwischen PKA und PKB als (bei 25ÖC)
PKA + PKB = 14
Was ist der Unterschied zwischen PKA und PKB?
PKA gegen PKB | |
| PKA ist der negative Logarithmus von Ka. | PKB ist der negative Logarithmus von KB. |
| Natur | |
| PKA wird für Säuren verabreicht. | PKB ist für Basen gegeben. |
| Beziehung zur Dissoziationskonstante | |
| PKA hängt mit der Dissoziationskonstante der Säure zusammen. | PKB hängt mit der Basis -Dissoziationskonstante zusammen. |
| Indikationen | |
| Kleiner der PKA -Wert, stärker die Säure. | Kleiner der PKB -Wert, schwächer die Basis. |
Zusammenfassung - PKA gegen PKB
PKA und PKB werden verwendet, um die Stärke von Säuren bzw. Basen zu vergleichen. PKA ist für Säuredissoziationen verabreicht. PKB wird zur Dissoziation von Basen verabreicht. Der Unterschied zwischen PKA und PKB besteht darin, dass PKA der negative Logarithmus von Ka ist, während PKB der negative Logarithmus von KB ist.
Laden Sie den PDF von PKA vs PKB herunter
Sie können die PDF -Version dieses Artikels herunterladen und sie für Offline -Zwecke gemäß Citation Note verwenden. Bitte laden Sie die PDF -Version hier herunter: Unterschied zwischen PKA und PKB
Referenz:
1.Helmenstine, Anne Marie, D. „PKA -Definition in der Chemie.”Thoughtco, Sep. 15, 2017. Hier verfügbar
2.Helmenstine, Anne Marie, D. „PH- und PKA-Beziehung: Die Henderson-Hasselbalch-Gleichung.”Thoughtco, dec. 1, 2017. Hier verfügbar
3.„Beziehung zwischen KA und KB." Khan Akademie. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'PKA Phenol gegen Nitrophenol'by Hbf878 - eigene Arbeit, (Public Domain) über Commons Wikimedia


