Unterschied zwischen Polypeptid und Protein

Polypeptid gegen Protein
Aminosäure ist ein einfaches Molekül, das mit C, H, O, N gebildet wird und kann s sein. Es hat die folgende allgemeine Struktur.
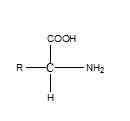
Es gibt ungefähr 20 häufige Aminosäuren. Alle Aminosäuren haben einen -cooh, -nh2 Gruppen und ein -h an einen Kohlenstoff gebunden. Der Kohlenstoff ist ein chiraler Kohlenstoff, und Alpha -Aminosäuren sind in der biologischen Welt die wichtigsten. Die R -Gruppe unterscheidet sich von Aminosäure zu Aminosäure. Die einfachste Aminosäure, bei der R -Gruppe H ist, ist Glycin. Nach der R -Gruppe können Aminosäuren in aliphatische, aromatische, nicht polare, polare, positiv geladene, negativ geladene oder polar ungeladene usw. kategorisiert werden. Aminosäuren, die als Zwitterionen im physiologischen pH 7 vorhanden sind.4. Aminosäuren sind die Bausteine von Proteinen. Wenn sich zwei Aminosäuren zusammenschließen, um ein Dipeptid zu bilden, findet die Kombination in einem -nh statt2 Gruppe einer Aminosäure mit der Gruppe einer anderen Aminosäure. Ein Wassermolekül wird entfernt und die gebildete Bindung wird als Peptidbindung bezeichnet.
Polypeptid
Die Kette bildet, wenn eine große Anzahl von Aminosäuren miteinander verbunden ist. Proteine bestehen aus einem oder mehreren dieser Polypeptidketten. Die Primärstruktur eines Proteins ist als Polypeptid bekannt. Aus den beiden Terminals der Polypeptidkette ist N-Terminus der Ort, an dem die Amino-Gruppe frei ist, und in der C-Terminus ist die Carboxylgruppe kostenlos. Polypeptide werden an Ribosomen synthetisiert. Die Aminosäuresequenz in der Polypeptidkette wird durch die Codons in mRNA bestimmt.
Eiweiß
Proteine sind eine der wichtigsten Arten von Makromolekülen in lebenden Organismen. Proteine können je nach Strukturen als primäre, sekundäre, tertiäre und quaternäre Proteine eingestuft werden. Die Sequenz von Aminosäuren (Polypeptid) in einem Protein wird als Primärstruktur bezeichnet. Wenn sich Polypeptidstrukturen in zufällige Anordnungen falten, werden sie als sekundäre Proteine bekannt. In Tertiärstrukturen haben Proteine eine dreidimensionale Struktur. Wenn nur wenige dreidimensionale Proteineinheiten zusammengebunden sind, bilden sie die quaternären Proteine. Die dreidimensionale Struktur von Proteinen hängt von den Wasserstoffbrückenbindungen, Disulfidbindungen, ionischen Bindungen, hydrophoben Wechselwirkungen und allen anderen intermolekularen Wechselwirkungen in Aminosäuren ab. Proteine spielen mehrere Rollen in lebenden Systemen. Sie nehmen an der Bildung von Strukturen teil. Zum Beispiel haben Muskeln Proteinfasern wie Kollagen und Elastin. Sie sind auch in harten und starren strukturellen Teilen wie Nägeln, Haaren, Hufen, Federn usw. gefunden. Weitere Proteine finden sich in Bindegeweben wie Knorpeln. Anders als die strukturelle Funktion haben Proteine auch eine Schutzfunktion. Antikörper sind Proteine, und sie schützen unseren Körper vor ausländischen Infektionen. Alle Enzyme sind Proteine. Enzyme sind die Hauptmoleküle, die alle Stoffwechselaktivitäten kontrollieren. Darüber hinaus nehmen Proteine an der Zellsignalisierung teil. Proteine werden auf Ribosomen produziert. Das Proteinproduktionssignal wird von den Genen in DNA auf das Ribosom weitergeleitet. Die erforderlichen Aminosäuren können aus der Ernährung stammen oder in der Zelle synthetisiert werden. Protein -Denaturierung führt zur Entfaltung und Desorganisation der sekundären und tertiären Strukturen der Proteine. Dies kann auf Wärme, organische Lösungsmittel, starke Säuren und Basen, Waschmittel, mechanische Kräfte usw. zurückzuführen sein.
| Was ist der Unterschied zwischen Polypeptid und Protein? • Polypeptide sind Aminosäuresequenz, während Proteine von einer oder mehreren Polypeptidketten hergestellt werden. • Proteine haben ein höheres Molekulargewicht als Polypeptide. • Proteine haben Wasserstoffbrückenbindungen, Disulfidbindungen und andere elektrostatische Wechselwirkungen, was seine dreidimensionale Struktur im Gegensatz zu Polypeptiden regiert. |


