Unterschied zwischen protischen und aprotischen Lösungsmitteln

Schlüsselunterschied - protisch vs Aprotisch Lösungsmittel
Der Schlüsselunterschied Zwischen protischen und aprotischen Lösungsmitteln ist das Protische Lösungsmittel weisen dissozibare Wasserstoffatome auf, während aprotische Lösungsmittel kein dissoziierbares Wasserstoffatom aufweisen.
Ein Lösungsmittel ist eine flüssige Verbindung, die andere Substanzen auflösen kann. Es gibt verschiedene Formen von Lösungsmitteln, die im Wesentlichen in zwei Gruppen als polare und unpolare Lösungsmittel eingeteilt werden können. Die polaren Lösungsmittel können in zwei Gruppen als protische und aprotische Lösungsmittel unterteilt werden. Protische Lösungsmittel können Wasserstoffbrückenbindungen bilden, da sie chemische Bindungen aufweisen, die für die Wasserstoffbindung erforderlich sind, i.e. O-H-Anleihe und N-H Bond. Im Gegensatz dazu fehlen ungenotische Lösungsmittel die für die Wasserstoffbrückenbindung erforderlichen chemischen Bindungen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind protische Lösungsmittel
3. Was sind aprotische Lösungsmittel
4. Ähnlichkeiten zwischen protischen und aprotischen Lösungsmitteln
5. Nebenseitiger Vergleich - Protisch gegen aprotische Lösungsmittel in tabellarischer Form
6. Zusammenfassung
Was sind protische Lösungsmittel?
Protische Lösungsmittel sind polare Flüssigverbindungen mit dissoziierbaren Wasserstoffatomen. Diese Lösungsmittel haben viele O-H-Anleihen und N-H-Bindungen. Die dissoziierbaren Wasserstoffatome sind solche, die an Sauerstoffatome und Stickstoffatome in diesen O-H- und N-H-Bindungen gebunden sind. Daher Hydroxylgruppen (-OH) und Amingruppen (-nh)2) sind wesentliche Komponenten in protischen Lösungsmitteln.
Protische Lösungsmittel teilen die Ionenlösungskraft mit aprotischen Lösungsmitteln und sind sauer (weil sie Protonen freisetzen können). Die Dielektrizitätskonstante dieser protischen Lösungsmittel ist sehr hoch (Dielektrizitätskonstante ist eine Eigenschaft elektrischer Isoliermaterialien und ist eine Menge, die die Fähigkeit einer Substanz misst, elektrische Energie in einem elektrischen Feld zu speichern).
Beispiele für protische Lösungsmittel umfassen Wasser, Alkohole wie Methanol und Ethanol, Wasserstofffluorid (HF) und Ammoniak (NH)3). Diese Lösungsmittel werden häufig verwendet, um Salze aufzulösen. Polare protische Lösungsmittel bevorzugen SN1 -Reaktionen.
Was sind aprotische Lösungsmittel?
Aprotische Lösungsmittel sind polare Flüssigkeitsverbindungen, die keine dissoziierbaren Wasserstoffatome aufweisen. In diesen Lösungsmitteln fehlen chemische Körper wie O-H-Bindungen und N-H-Bindungen. Daher fehlen uprotische Lösungsmittel Hydroxylgruppen (-OH) und Amingruppen (-nh2) und können keine Wasserstoffbrückenbindungen bilden.
Aprotische Lösungsmittel teilen Ionenlösungskraft mit protischen Lösungsmitteln. Diese aprotischen Lösungsmittel fehlen sauren Wasserstoff, daher keine beträchtliche Freisetzung von Wasserstoffionen. Polare aprotische Lösungsmittel haben niedrige oder intermediäre Dielektrizitätskonstantewerte. Diese Lösungsmittel zeigen eine moderate Polarität.
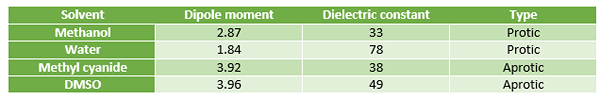
Abbildung 01: Vergleich zwischen protischen und aprotischen Lösungsmitteln
Beispiele für aprotische Lösungsmittel sind Dichlormethan (DCM), Tetrahydrofuran (THF), Ethylacetat und Aceton. Oprotische Lösungsmittel können verwendet werden, um Salze aufzulösen. Diese Lösungsmittel ziehen es vor, SN2 -Reaktionen zu unterziehen.
Was sind die Ähnlichkeiten zwischen protischen und aprotischen Lösungsmitteln?
- Sowohl protische als auch aprotische Lösungsmittel sind polare Lösungsmittel.
- Sowohl protische als auch aprotische Lösungsmittellösungsmittel können Salze auflösen.
Was ist der Unterschied zwischen protischen und aprotischen Lösungsmitteln?
Protische gegen aprotische Lösungsmittel | |
| Protische Lösungsmittel sind polare Flüssigverbindungen mit dissoziierbaren Wasserstoffatomen. | Aprotische Lösungsmittel sind polare Flüssigkeitsverbindungen, die keine dissoziierbaren Wasserstoffatome aufweisen. |
| Bildung von Wasserstoffbrückenbindungen | |
| Protische Lösungsmittel können zur Bildung von Wasserstoffbrückenbindungen in der Lage sein. | Aprotische Lösungsmittel können keine Wasserstoffbrückenbindungen bilden. |
| Säure | |
| Protische Lösungsmittel sind sauer. | Aprotische Lösungsmittel sind nicht sauer. |
| Chemische Bindungen vorhanden | |
| Protische Lösungsmittel sind reich an O-H-Bindungen und N-H-Bindungen. | Bei aprotischen Lösungsmitteln fehlen O-H-Bindungen und N-H-Bindungen. |
| Dielektrizitätskonstante | |
| Protische Lösungsmittel haben eine hohe Dielektrizitätskonstante. | Aprotische Lösungsmittel haben eine niedrige Dielektrizitätskonstante. |
| Bevorzugter Reaktionstyp | |
| Protische Lösungsmittel ziehen es vor, SN1 -Reaktionen zu unterziehen. | Aprotische Lösungsmittel ziehen es vor, SN2 -Reaktionen zu unterziehen. |
Zusammenfassung -Protisch vs Aprotisch Lösungsmittel
Lösungsmittel sind Flüssigkeiten, die Substanzen auflösen können. Lösungsmittel können in zwei Hauptformen als polare Lösungsmittel und unpolare Lösungsmittel gefunden werden. Polare Lösungsmittel können erneut in zwei Gruppen als protische Lösungsmittel und aprotische Lösungsmittel unterteilt werden. Der Unterschied zwischen protischen und aprotischen Lösungsmitteln besteht darin.
Referenz:
1.„Polar Protik? Polar aprotische? Unpolar? Alles über Lösungsmittel.”Master organische Chemie RSS. Hier verfügbar
2.„Protisches Lösungsmittel.Wikipedia, Wikimedia Foundation, 17. Dezember. 2017. Hier verfügbar
3.„Aprotische und protische Lösungsmittel.Scribd, Scribd. Hier verfügbar


