Differenz zwischen Ratengesetz und Massenklage
Schlüsselunterschied - Ratengesetz im Vergleich zum Gesetz der Massenaktion
Der Schlüsselunterschied Zwischen dem Ratengesetz und dem Gesetz der Massenaktion ist das Das Geschwindigkeitsgesetz gibt die Beziehung zwischen der Geschwindigkeit einer chemischen Reaktion und den Konzentrationen von Reaktanten an, während das Gesetz der Massenaktion feststellt, dass die Geschwindigkeit einer chemischen Reaktion proportional zu den Massen der reagierenden Substanzen ist.
Das Ratengesetz ist ein Gesetz in der Chemie, das verwendet wird, um das Verhalten eines Reaktionsgemisches zu erklären. Das Geschwindigkeitsgesetz zeigt an, dass eine Reaktionsgeschwindigkeit direkt proportional zur Reaktionsgeschwindigkeit ist. Die Verhältnismäßigkeitskonstante wird als Geschwindigkeitskonstante bezeichnet. Das Gesetz der Massenwirkung zeigt, dass die Reaktionsgeschwindigkeit einer chemischen Reaktion direkt proportional zum Produkt von Reaktantenmassen ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ratengesetz
3. Was ist das Gesetz des Massenaktionens
4. Seite an Seitenvergleich - Ratengesetz gegen Massenklage in tabellarischer Form
5. Zusammenfassung
Was ist Ratengesetz?
Das Geschwindigkeitsgesetz gibt die Beziehung zwischen der Geschwindigkeit einer chemischen Reaktion und den Konzentrationen der Reaktanten an. Gemäß dem Geschwindigkeitsgesetz ist die Reaktionsgeschwindigkeit direkt proportional zu den Konzentrationen von Reaktanten, die zu einer Macht angehoben werden (sie ist häufig gleich der stöchiometrischen Beziehung in der chemischen Gleichung), die experimentell bestimmt wird.
Das Ratengesetz finden Sie in zwei Typen wie folgt:
- Differentialrategesetz
Das Differentialrate -Gesetz gibt die Reaktionsrate als Funktion der Änderung der Konzentration der Reaktanten während eines bestimmten Zeitraums an.
- Integriertes Ratengesetz
Das integrierte Rate -Gesetz gibt die Reaktionsrate als Funktion der anfänglichen Konzentration eines Reaktanten zu einem bestimmten Zeitraum an.
Betrachten wir ein Beispiel, um dies zu verstehen.
AA +BB → CC +DD
Rate = k [a]A[B]B
Die obige Gleichung gibt den mathematischen Ausdruck des Ratengesetzes an. Dort ist „K“ eine Verhältnismäßigkeitskonstante. Es ist als Ratenkonstante bekannt. Die Exponenten „A“ und „B“ sind die Reaktionsordnungen in Bezug auf den Reaktanten A bzw. B. Die Gesamtreihenfolge (P) der Reaktion wird als Summe aller Bestellungen in der Ratenrechtsgleichung angegeben.
p = a + b

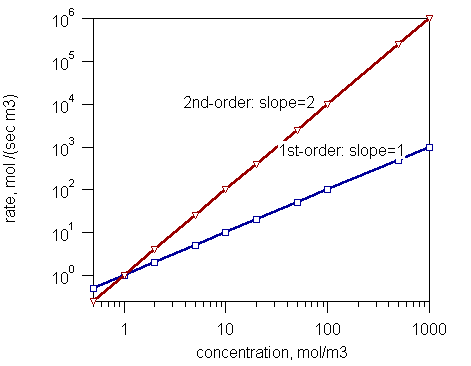
Abbildung 1: Reaktionsgeschwindigkeit und die Konzentration von Reaktionen erster Ordnung und Reaktionen zweiter Ordnung.
Basierend auf der Gesamtreihenfolge einer Reaktion sind die Reaktionen in drei Typen wie folgt:
- Reaktionen ohne Ordnung - die Reaktionsgeschwindigkeit ist unabhängig von der Konzentration der Reaktanten
- Reaktionen erster Ordnung - Die Reaktionsgeschwindigkeit ist proportional zur Konzentration eines Reaktanten.
- Reaktionen zweiter Ordnung - Die Reaktionsgeschwindigkeit ist entweder für das Produkt der Konzentrationen zweier Reaktanten oder zum Quadrat der Konzentration eines Reaktantens proportional.
Was ist das Gesetz des Massenaktionens?
Das Gesetz der Massenaktion zeigt, dass die Geschwindigkeit einer chemischen Reaktion proportional zu den Massen der reagierenden Substanzen ist. Es ist auch als die bekannt Massenaktionsgesetz. Dieses Gesetz ist nützlich, um die genaue Gleichgewichtsgleichung einer bestimmten chemischen Reaktion zu erhalten. Das Gesetz wird auch durch Aktivitäten oder Konzentrationen von Reaktanten gegeben. Nach dem Massenwirkungsgesetz ist das Verhältnis zwischen Produktkonzentrationen und Reaktanten eine Konstante in einem Reaktionsgemisch, das sich in einem Gleichgewichtszustand befindet.
Das Gesetz der Massenaktion ist ein universelles Konzept, was bedeutet, dass es für jedes System unter allen Umständen anwendbar ist. Dieses Gesetz kann in einem mathematischen Ausdruck wie unten angegeben werden.
Für die Reaktion,
aa +bb ↔ cc +dd
Das Verhältnis zwischen Produkten und Reaktanten im Gleichgewicht;
Keq = [c]C[D]D / [A]A[B]B
Bei einer bestimmten Temperatur ist das obige Verhältnis eine Konstante für das Gleichgewicht zwischen Reaktanten (A und B) und Produkten (C und D). Hier ist Keq als Gleichgewichtskonstante bekannt.
Was ist der Unterschied zwischen dem Ratengesetz und dem Gesetz des Massenakts?
Bewertungsgesetz gegen Massenklage | |
| Das Geschwindigkeitsgesetz zeigt an, dass die Reaktionsgeschwindigkeit direkt proportional zu den Konzentrationen von Reaktanten ist, die zu einer experimentellen Leistung angehoben werden. | Das Gesetz der Massenaktion zeigt, dass die Geschwindigkeit einer chemischen Reaktion proportional zu den Massen der reagierenden Substanzen ist. |
| Komponenten der Gleichung | |
| Die Geschwindigkeitsrechtsgleichung hat eine Geschwindigkeitskonstante, die Reaktantenkonzentrationen und die Reaktionsreihenfolge. | Das Gesetz der Massenaktion hat eine Gleichung, die sich aus Produktkonzentrationen und Reaktanten zusammensetzt. |
| Produkt | |
| Die Rate -Gesetzgleichung enthält keine Produktkonzentrationen von Produkten. | Das Gesetz der Massenaktionsgleichung enthält die Produktkonzentrationen. |
| Verhältnismäßigkeitskomponente | |
| Die Verhältnismäßigkeitskonstante der Ratenrechtsgleichung wird als Ratenkonstante „K“ bezeichnet. | Das Gesetz der Massenaktionsgleichung ist keine Verhältnismäßigkeitskonstante. |
Zusammenfassung - Zinsgesetz gegen Massenklagegesetz
Die Ratengesetze und das Gesetz der Massenaktion werden verwendet, um das Verhalten eines Reaktionsgemisches zu erklären. Der Schlüsselunterschied zwischen Ratengesetz und Massenakte ist, dass das Geschwindigkeitsgesetz die Beziehung zwischen der Geschwindigkeit einer chemischen Reaktion und den Konzentrationen der Reaktanten angibt, während das Gesetz der Massenwirkung darauf hinweist, dass die Geschwindigkeit einer chemischen Reaktion proportional zu den Konzentrationen von ist die reagierenden Substanzen.
Referenz:
1. „Das Tarifgesetz.”Chemistry Libretexten, 21. Juli 2016, hier erhältlich.
2. „12.3 Ratengesetze.Chemie, hier erhältlich.
3. Laidler, Keith J. „Gesetz des Massenakts.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 26. Oktober. 2016, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "RatelogLogplot" von Fabiuccio ~ Enwikibooks bei English Wikibooks - Transfer von EN.Wikibooks zu Commons., (Public Domain) über Commons Wikimedia