Unterschied zwischen gesättigter und konzentrierter Lösung
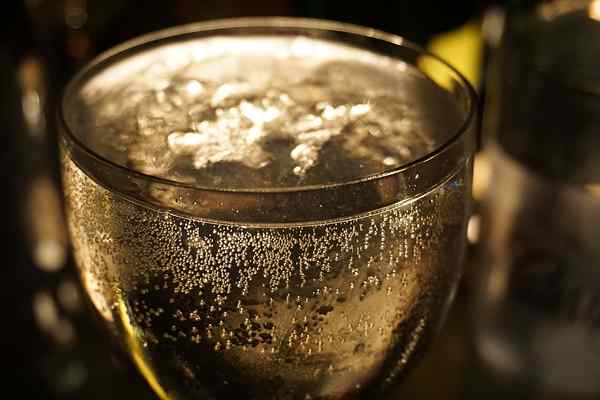
Schlüsselunterschied - gesättigt vs KonceNtrated Lösung
Eine Lösung ist eine flüssige Phase der Materie, die durch Auflösen eines gelösten Stoffes in einem Lösungsmittel gebildet wird. Eine Lösung kann in eine gesättigte Lösung umgewandelt werden, indem mehr gelöste gelöste hinzugefügt werden, bis keine mehr gelösten gelöst werden können. Eine konzentrierte Lösung enthält eine beträchtlich hohe Menge an gelösten Stoffs, aber diese Menge ist nicht maximal. Der Schlüsselunterschied zwischen gesättigter und konzentrierter Lösung ist das Zusätzliche Stoffe können nicht in einer gesättigten Lösung gelöst werden, da sie die maximale Menge an gelösten Stoffen enthält, während zusätzliche gelöste gelöste in einer konzentrierten Lösung gelöst werden können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist gesättigte Lösung
3. Was ist eine konzentrierte Lösung
4. Ähnlichkeiten zwischen gesättigter und konzentrierter Lösung
5. Seite für Seitenvergleich - gesättigte und konzentrierte Lösung in tabellarischer Form
6. Zusammenfassung
Was ist gesättigte Lösung?
Eine gesättigte Lösung ist eine chemische Lösung, die die maximale Konzentration eines im Lösungsmittels gelösten gelösten gelösten gelösten gelösten gelösten gelösten. Zusätzliche gelöste gelöste können nicht in einer gesättigten Lösung gelöst werden, da sie die maximale Menge an gelösten Stoffen enthält. Die entgegengesetzte Form der gesättigten Lösung ist die ungesättigte Lösung. Die ungesättigte Lösung ist nicht mit dem gelösten Stoff gesättigt. Eine ungesättigte Lösung kann entweder eine konzentrierte Lösung oder eine verdünnte Lösung sein.
Es gibt mehrere Faktoren, die die Sättigung einer Lösung beeinflussen. Diese Faktoren beeinflussen die Auflösung von gelösten Stoffen im Lösungsmittel.
- Temperatur - Die Löslichkeit von festen Verbindungen nimmt mit zunehmender Temperatur des Lösungsmittels zu. Daher können mehr gelöste Stoffe im heißen Lösungsmittel als im kalten Lösungsmittel gelöst werden.
- Druck - mehr gelöste Stoffe können Kräfte sein, um sich im Lösungsmittel aufzulösen, indem sie Druck ausüben. Daher kann die Auflösung von gelösten Stoffen durch Erhöhen des Druckdrucks erhöht werden. Beispiel: Gase.
- Chemische Zusammensetzung - Wenn in der Lösung bereits einige andere gelöste gelöste vorhanden sind, beeinflusst sie die Löslichkeit von gelösten Stoffen.
Eine gesättigte Lösung kann erzeugt werden, indem ein gelöster Stoff zum Lösungsmittel hinzugefügt wird, bis sich nicht mehr gelöste Stoffe auflösen. Oder kann durch Verdampfen des Lösungsmittels der Lösung durchgeführt werden, bis der gelöste Stoff zu Kristallen bildet. Eine andere Methode, obwohl nicht so häufig, besteht darin, einer übersättigten Lösung Samen von Kristallen hinzuzufügen. Eine übersättigte Lösung enthält viele gelöste Stoffe, die aufgelöst bleiben, auch wenn die Lösung abgekühlt ist. Wenn dieser übersättigten Lösung Samen von Kristallen hinzugefügt werden, werden die gelösten Stoffe zu kristallisieren, was eine gesättigte Lösung ergibt.
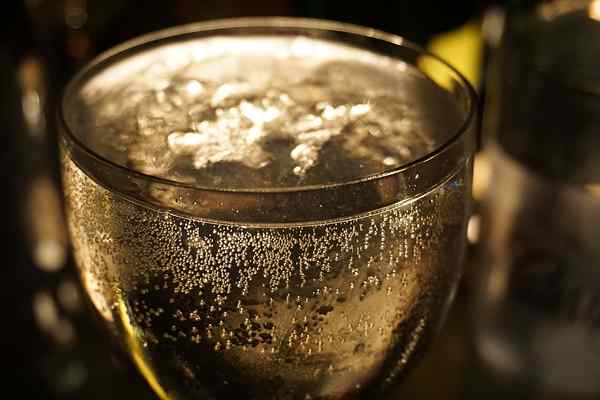
Abbildung 01: Sprudelsäfte sind gesättigte Lösungen
Einige Beispiele für gesättigte Lösungen umfassen kohlensäurehaltiges Wasser (mit Kohlenstoff gesättigt), gesättigte Zuckerlösungen (kein Zucker kann gelöst werden), Bier oder Sekten mit Kohlendioxid usw. gesättigt sind usw.
Was ist eine konzentrierte Lösung?
Eine konzentrierte Lösung ist eine chemische Lösung, die eine hohe Menge eines im Lösungsmittels gelösten gelösten gelösten gelösten gelösten gelösten. Zusätzliche gelöste gelöste können in einer konzentrierten Lösung gelöst werden, da sie nicht die maximale Menge an gelösten gelösten enthält (nicht mit dem gelösten Stoff gesättigt). Die entgegengesetzte Form der konzentrierten Lösung ist verdünnte Lösung. Eine verdünnte Lösung enthält eine relativ geringe Menge an gelösten gelösten gelösten gelösten gelöst.

Abbildung 02: Eine konzentrierte Lösung (rechts) hat eine starke Farbe im Vergleich zu einer verdünnten Lösung (links)
Die konzentrierten Lösungen von Säuren oder Basen werden als starke Säuren oder starke Basen erkannt. Im Gegensatz dazu sind verdünnte Säuren oder Basen schwache Säuren oder Basen. Der konzentrierte Begriff wird verwendet, um eine quantitative Vorstellung von einer Lösung zu geben. Eine konzentrierte Lösung kann gebildet werden, indem mehr gelöste Stoffe in eine Lösung auflöst oder eine Lösung verdunstet. Die Konzentration einer Lösung kann wie unten angegeben werden. Dort wird die Konzentration durch die Einheit mol/l gegeben.
Konzentration = Anzahl der Mol aus gelösten Stoff- / Volumen der Lösung
Was sind die Ähnlichkeiten zwischen gesättigter und konzentrierter Lösung?
- Sowohl gesättigte als auch konzentrierte Lösungen sind Lösungen, die eine hohe Menge an gelösten gelösten Stoffe enthalten
- Sowohl gesättigte als auch konzentrierte Lösungsbegriffe drücken eine quantitative Idee von Lösungen aus.
Was ist der Unterschied zwischen gesättigter und konzentrierter Lösung?
Gesättigte und konzentrierte Lösung | |
| Eine gesättigte Lösung ist eine chemische Lösung, die die maximale Konzentration eines im Lösungsmittels gelösten gelösten gelösten gelösten gelösten gelösten gelösten. | Eine konzentrierte Lösung ist eine chemische Lösung, die eine hohe Menge eines im Lösungsmittels gelösten gelösten gelösten gelösten gelösten gelösten. |
| Menge der gelösten Stoffe | |
| Die gesättigte Lösung enthält die maximale Menge an gelösten gelösten Stoffe, die sie halten kann. | Die konzentrierte Lösung enthält eine erheblich hohe Menge an gelösten Stoff. |
| Zugabe von mehr gelösten gelösten | |
| Zusätzliche Stoffe können nicht in einer gesättigten Lösung gelöst werden, da sie das Maximum enthält. | Zusätzliche gelöste gelöste können in einer konzentrierten Lösung gelöst werden, da sie nicht die maximale Menge an gelösten gelösten enthält (nicht mit dem gelösten Stoff gesättigt). |
| Entgegengesetzte Form | |
| Die entgegengesetzte Form der gesättigten Lösung ist eine ungesättigte Lösung. | Die entgegengesetzte Form einer konzentrierten Lösung ist eine verdünnte Lösung. |
| Beispiele | |
| Einige Beispiele für gesättigte Lösungen umfassen kohlensäurehaltiges Wasser, gesättigte Zuckerlösungen, Bier oder Sekten mit Kohlendioxid usw., usw. | Einige Beispiele für konzentrierte Lösungen umfassen konzentrierte Säuren und konzentrierte Basen, die in Laboratorien verwendet werden. |
Zusammenfassung -gesättigt vs KonceNtrated Lösung
Eine gesättigte Lösung ist eine Form einer konzentrierten Lösung, enthält jedoch die maximale Menge an gelösten gelösten Stoffe, die halten können. Die Differenz zwischen gesättigter und konzentrierter Lösung besteht darin, dass zusätzliche gelöste gelöste nicht in einer gesättigten Lösung gelöst werden können der gelöste).
Referenz:
1.„13.2: gesättigte Lösungen und Löslichkeit.Chemie -Libretexte, Libretexte, 8. Oktober. 2017. Hier verfügbar
2.„Wie man eine Lösung konzentriert.Sciencecing. Hier verfügbar
3.Helmenstine, Anne Marie, D. „Definition der gesättigten Lösung und Beispiele.”Thoughtco, Jun. 20, 2017. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'2980956' von Nicole_80 (Public Domain) über Pixabay
2.'Riboflavinsolution'by sbharris - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia


