Unterschied zwischen gesättigten und ungesättigten Bindungen
Der Schlüsselunterschied Zwischen gesättigten und ungesättigten Bindungen ist das Eine gesättigte Bindung hat keine PI -Bindungen, während ungesättigte Bindungen immer PI -Bindungen haben.
Chemische Bindungen sind die Verbindungen zwischen Atomen. Diese Bindungen verursachen die Bildung von Molekülen. Es gibt zwei Haupttypen von Bindungen; Sie sind die kovalenten Bindungen und ionischen Bindungen. Die Bindungen in Metallen sind jedoch metallische Bindungen. Kovalente Bindungen bilden sich, wenn zwei Atome ihre Valenzelektronen teilen. Diese kovalenten Bindungen können je nach Anzahl und Art der Bindung, die zwischen zwei Atomen bestehen, entweder gesättigt oder ungesättigt sein.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind gesättigte Bindungen
3. Was sind ungesättigte Anleihen
4. Seite an Seite Vergleich - gesättigte und ungesättigte Bindungen in tabellarischer Form
5. Zusammenfassung
Was sind gesättigte Bindungen?
Gesättigte Bindungen sind einzelne Bindungen. Dies sind kovalente chemische Bindungen. Dort binden zwei Atome über eine Sigma -Bindung miteinander, und daher gibt es keine PI -Bindungen - die Bindungsformen mit zwei Elektronen; Ein Elektron aus jedem der beiden Atome, die diese Bindung bilden. Diese Elektronen sind die Valenzelektronen der Atome. Die Bindungsstärke dieser Art von Bindung ist vergleichsweise schwach. Die beiden gemeinsamen Elektronen existieren zwischen den Atomen, und das elektronegativere Atom wird die Elektronen zu sich selbst anziehen.
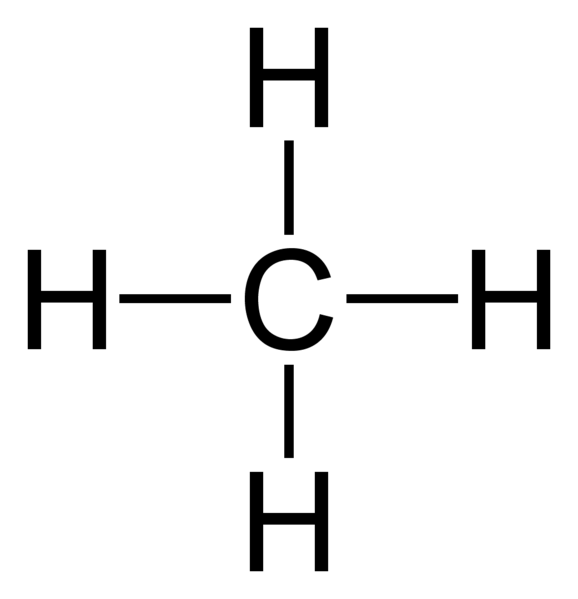
Abbildung 01: Methan ist eine gesättigte Verbindung, da es vier gesättigte Bindungen aufweist
Darüber hinaus hat diese Art von Bindung die Fähigkeit, sich Rotationen zu unterziehen. Dort wirkt diese Bindung als Drehachse. Eine gesättigte Bindung bildet sich, wenn die Orbitale folgen, die sich überlappen.
- Zwei S -Orbitale
- Zwei pz Orbitale
- S und pz Orbital
- Zwei dz2 Orbitale
- Lineare Überlappung von Hybridorbitalen.
Was sind ungesättigte Anleihen?
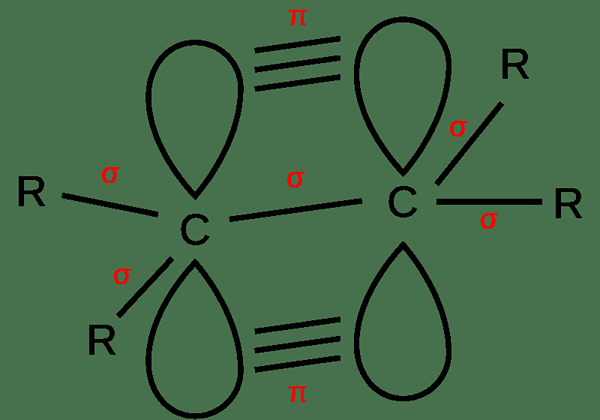
Ungesättigte Bindungen sind Doppelbindungen und dreifache Bindungen zwischen zwei Atomen. Dies sind kovalente Bindungen. Daher werden Elektronen zwischen Atomen geteilt. Darüber hinaus gibt es auch Sigma -Anleihen und PI -Anleihen. In einer Doppelbindung gibt es eine Sigma -Bindung und eine PI -Bindung zwischen zwei Atomen. In einer dreifachen Bindung gibt es eine Sigma -Bindung und zwei PI -Anleihen. Eine Sigma -Bindung bildet sich aufgrund einer linearen Überlappung von Atomorbitalen, während sich die PI -Bindungen aufgrund einer parallelen Überlappung bilden.

Abbildung 02: Bildung einer Doppelbindung
Außerdem hat eine Doppelbindung vier Bindungselektronen zwischen Atomen, während die Dreifachbindung dort sechs Elektronen hat. Aufgrund dieser großen Anzahl von Elektronen zwischen Atomen in ungesättigten Bindungen sind diese Bindungen tendenziell reaktiver. Darüber hinaus sind diese Bindungen stärker und kürzer als einzelne Bindungen.
Was ist der Unterschied zwischen gesättigten und ungesättigten Bindungen?
Gesättigte Bindungen sind einzelne Bindungen, und ungesättigte Bindungen sind Doppelbindungen und dreifache Bindungen zwischen zwei Atomen. Der Hauptunterschied zwischen gesättigten und ungesättigten Bindungen besteht darin, dass eine gesättigte Bindung keine PI -Bindungen hat, während ungesättigte Bindungen immer PI -Bindungen haben. Ein weiterer Unterschied zwischen gesättigten und ungesättigten Bindungen besteht darin, dass es ein Elektronenpaar zwischen zwei Atomen in einer gesättigten Bindung gibt, während zwei oder drei Elektronenpaare zwischen Atomen in ungesättigten Bindungen bestehen.
Darüber hinaus besteht ein wichtiger Unterschied zwischen gesättigten und ungesättigten Bindungen darin, dass die gesättigten Bindungen vergleichsweise schwach, lang und weniger reaktiv sind, während die ungesättigten Bindungen stark, kurz und reaktiv sind. Darüber hinaus können gesättigte Bindungen Drehungen durchlaufen, während ungesättigte Bindungen dies nicht können.
Die folgende Infografik ist eine Vergleichsübersicht über den Unterschied zwischen gesättigten und ungesättigten Bindungen.
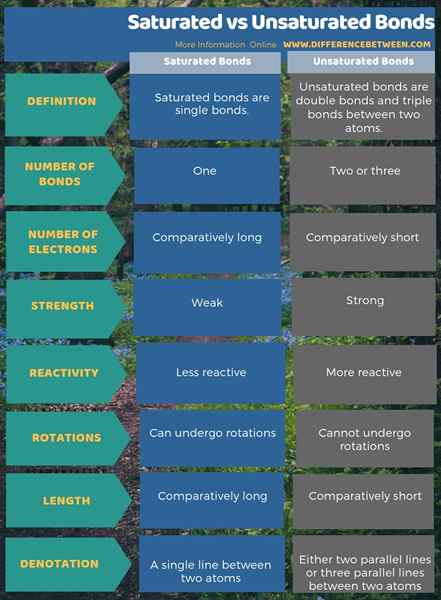
Zusammenfassung - gesättigtes gegen ungesättigte Bindungen
Zusammenfassend sind gesättigte Bindungen einzelne kovalente Bindungen, während ungesättigte Bindungen doppelte und dreifache Bindungen sind. Daher besteht der Hauptunterschied zwischen gesättigten und ungesättigten Bindungen darin, dass eine gesättigte Bindung keine PI -Bindungen aufweist, während ungesättigte Bindungen immer PI -Bindungen haben.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Doppelbindungsdefinition und Beispiele in der Chemie.”Thoughtco, Sep. 8, 2017. Hier verfügbar
2. Britannica, die Herausgeber von Encyclopaedia. „Dreifach Bond.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 14 Apr. 2011. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Methan-2D-Quadrat" (Public Domain) über Commons Wikimedia
2."Doppelbindungen" von Fred the Oysteri (CC BY-SA 4.0) über Commons Wikimedia


