Unterschied zwischen SDS -Seite und native Seite

Schlüsselunterschied - SDS -Seite gegen native Buchseite
SDS und native Seite sind zwei Arten von Polyacrylamid -Gelelektrophorese -Techniken, die in der Molekülbiologie verwendet werden. Der Schlüsselunterschied Zwischen der SDS -Seite und der nativen Seite befindet sich die Art des verwendeten Polyacrylamidgels. In SDS Seite wird daher ein Denaturierungsgel verwendet. Im Gegensatz dazu werden auf der nativen Seite nicht der Ursachen verwendet. Daher werden Moleküle basierend auf Größe, Ladung und Form getrennt.
Polyacrylamidgelelektrophorese (Page) verwendet ein Gel, das durch polymerisierende Acrylamidmonomere mit Methylen -Bisacrylamid hergestellt wird. Das Polyacrylamid ist härter und hitziger stabiler als Agarose. Die Polyacrylamidgele haben eine kleinere Porengröße, die die effiziente Trennung von Proteinen ermöglicht. Es gibt zwei Haupttypen von Seiten -Setups, nämlich SDS -Seite und native Seite. SDS -Seite oder Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese trennt Proteine basierend auf ihren molekularen Gewichten. Denaturierende Gele werden auf der SDS -Seite verwendet. Native Page verwendet nicht entenkte Gele und trennt Proteine basierend auf ihrer Größe, Ladung und der Form (3D-Konformation).
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist SDS -Seite
3. Was ist einheimische Seite
4. Ähnlichkeiten zwischen der SDS -Seite und der nativen Seite
5. Seite für Seite Vergleich - SDS -Seite gegen native Seite in tabellarischer Form
6. Zusammenfassung
Was ist SDS -Seite?
SDS -Seite ist die häufigste elektrophoretische Technik, mit der Proteine basierend auf ihrem Molekulargewicht getrennt werden. Das Gel wird durch Hinzufügen von SDs (Natriumdodecylsulfat) hergestellt, das ein Reinigungsmittel ist. SDS -Zahnersatzproteine in Monomere. SDS ist ein anionisches Reinigungsmittel. Daher fügt es den Proteinen innerhalb eines weiten pH -Bereichs eine negative Netto -Ladung hinzu. Wenn die Netto -negativen Ladung aufgrund der Ladungsvariation auf den Proteinmolekülen vermittelt wird, werden die komplexen Strukturen abgebaut. Aufgrund der negativen Ladung ziehen Proteine zum positiven Ende an. Somit reisen Moleküle mit niedrigerem Molekulargewicht schneller auf der Gelmatrix und können in der Nähe der Anode beobachtet werden, während die höheren Molekulargewichtsproteine näher an den Brunnen beobachtet werden.
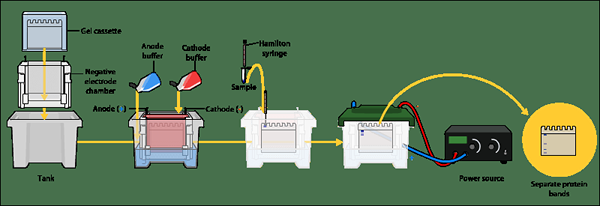
Abbildung 01: SDS -Seite
Die SDS -Bindung an die Polypeptidkette ist proportional zu ihrer relativen Molekülmasse. Daher kann die molekulare Masse auch über die SDS -Seite bestimmt werden. Die Färbung der SDS -Seitengele erfolgt durch Bromophenolblau -Färbung. Anwendungen des SDS -Seitenbereichs in größerem Maße, in dem sie verwendet werden kann, um die relative Molekülmasse abzuschätzen und die relative Häufigkeit von Proteinen in einem Proteingemisch zu bestimmen. Die SDS -Seite kann auch verwendet werden, um die Proteinverteilung in einer Mischung aus Proteinen zu bestimmen. Die SDS -Seite wird auch angewendet, um Proteine zu reinigen und zu bewerten. Es wird als vorläufiges Verfahren für Western Blot und Hybridisierung verwendet, was wiederum für die Proteinkartierung und Identifizierung verwendet wird.
Was ist einheimische Seite?
Native Polyacrylamid -Gelelektrophorese (native Seite) verwendet ein nicht denaturierendes Gel. Daher werden SDs oder ein anderer Denaturierungsagent nicht zur Gelmatrix hinzugefügt. Auf der nativen Seite basiert die Trennung von Proteinen auf der Ladung und der Größe des Proteins. Daher hängt die Mobilität des Proteins von der Ladung und der Größe des Proteins ab.
Die Ladung des Proteins hängt von den Seitenketten der Aminosäuren ab. Wenn die Seitenketten negativ aufgeladen sind, erhält das Protein eine negative Gesamtladung und umgekehrt. Proteine behalten eine 3D -Konformation aufgrund der Faltung, die stattfindet. Faltungsergebnisse aus den verschiedenen Bindungsarten in Proteinen wie Disulfidbrücken, hydrophoben Wechselwirkungen und Wasserstoffbrückenbindungen. Wenn die native Seite in einem neutralen pH -Wert getragen wird, werden die Proteine nach der molekularen Form des Proteins getrennt. Daher kann eine native Seite als empfindliche Technik verwendet werden.
Der Hauptvorteil der nativen Seite besteht darin, dass das für die Seitenanalyse verwendete Protein nach der Seitenanalyse in seinem ursprünglichen Zustand gewonnen werden kann, da das Protein während des Prozesses nicht gestört wird. Native Page ist eine relativ hohe Durchsatztechnik, und die Stabilität des Proteins ist erhöht.

Abbildung 02: native Seite
Nach Abschluss des Gelauf. Die Anwendungen der nativen Seite umfassen die Trennung saurer Proteine, einschließlich Glykoproteinen wie menschlichem rekombinantem Erythropoietin oder der Identifizierung von Proteinen, die in Rinderserumalbumin (BSA) vorhanden sind.
Was sind die Ähnlichkeiten zwischen der SDS -Seite und der nativen Seite?
- Beide SDS -Seite und native Seitensysteme verwenden Polyacrylamidgel als Matrix des Gels.
- Beide werden zur Trennung und Identifizierung von Proteinen verwendet.
- Beide verwenden die elektrophoretische Mobilität, um die Verbindungen zu trennen.
- Beide können auf vertikale oder horizontale Weise durchgeführt werden (meistens als vertikale Seitenaufbauten, da die Lauflänge mehr beträgt).
- Die Elektrophorese -Apparatur einschließlich des Gels, Kämmen, die Stromversorgung ist für den Betrieb beider Techniken erforderlich.
- Die Visualisierung des Gels kann durch Färbemethoden in beiden Techniken erfolgen.
Was ist der Unterschied zwischen der SDS -Seite und der nativen Seite?
SDS -Seite gegen native Seite | |
| SDS-Seite oder Natriumdodekylsulfat-Seite trennt Proteine basierend auf ihrem Molekulargewicht und verwendet ein Denaturierungsgel. | Native Page verwendet nicht entenkte Gele und trennt Proteine basierend auf ihrer Größe, Ladung und der Form (3D-Konformation). |
| Art des Gels | |
| Ein Denaturiergel wird auf der SDS-Seite verwendet. | Auf der nativen Seite wird ein nicht -denaturierendes Gel verwendet. |
| Vorhandensein von SDS | |
| SDS ist als Reinigungsmittel vorhanden, um eine negative Ladung auf der Stichprobe auf der SDS -Seite zu erteilen. | SDS ist auf der nativen Seite nicht vorhanden. |
| Trennungsbasis | |
| Die Trennung von Proteinen hängt vom Molekulargewicht des Proteins auf der SDS -Seite ab. | Die Trennung hängt von der Größe und Form des Proteinmoleküls auf der nativen Seite ab. |
| Stabilität des Proteins | |
| Die Stabilität des Proteins ist in der SDS -Seite gering ist. | Die Stabilität von Protein ist hoch auf der nativen Seite. |
| Wiederherstellung des ursprünglichen Proteins | |
| Nicht möglich, da es auf der SDS -Seite denaturiert ist. | Möglich auf der einheimischen Seite. |
Zusammenfassung - SDS -Seite gegen native Buchseite
SDS -Seite und native Seite sind zwei Arten von Polyacrylamid -Gelelektrophorese -Techniken, die zur Trennung von Proteinen verwendet werden. Die SDS -Seite wird mit einem Waschmittel namens SDS behandelt. SDs verleiht dem Protein eine negative Ladung insgesamt, was dann zur Denaturierung des Proteins führt. Daher werden die Proteine basierend auf ihrem Molekulargewicht getrennt. Im Gegensatz dazu verwendet die native Seitentechnik keinen Denaturierungsagenten. Somit werden die Proteine entweder basierend auf ihrer Größe oder der Form getrennt. Dies ist der Unterschied zwischen der SDS -Seite und der nativen Seite.
Referenz:
1.„Das Prinzip und die Methode der Polyacrylamid-Gelelektrophorese (SDS-PAGE).Das Prinzip und die Methode der Polyacrylamid-Gelelektrophorese (SDS-PAGE) | MBL Life Sience -asia-. Hier verfügbar
2.„Einheimische Gele.”Alliance Protein Laboratorien | Biophysikalische Charakterisierungsdienste. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'SDS-PAGE-Elektrophorese'by Bensaccount in englischer Wikipedia (CC von 3.0) über Commons Wikimedia
2.'Last eine Probe in eine Polyacrylamid-Gelelektrophorese Well'by Blaz Nemec aus Ljubljana, Slowenien (CC BY-SA 2).0) über Commons Wikimedia


