Unterschied zwischen einem Elektrodenpotential und dem Standard -Elektrodenpotential
Der Schlüsselunterschied Zwischen dem einzelnen Elektrodenpotential und dem Standard -Elektrodenpotential besteht das Ein einzelnes Elektrodenpotential ist das Potential einer einzelnen Elektrode in einer elektrochemischen Zelle, während das Standard -Elektrodenpotential die Potentialdifferenz zwischen zwei Elektroden unter Standardbedingungen ist.
Eine elektrochemische Zelle ist eine Vorrichtung, die entweder mit chemischen Reaktionen Elektrizität erzeugen oder Elektrizität verwenden kann, um chemische Reaktionen zu verursachen. Es hat zwei Elektroden als Kathode und Anode. Jede Elektrode wird als halbe Zelle bezeichnet, wo eine halbe Reaktion einer Redoxreaktion stattfindet. Der Strom wird aufgrund des elektrischen Potentials zwischen zwei Elektroden erzeugt. Wenn wir das Potenzial einer halben Zelle betrachten, nennen wir es „einzelnes Elektrodenpotential“. Wir können es nicht messen und es wird immer im Vergleich zum Potential der anderen Elektrode gemessen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein einzelnes Elektrodenpotential
3. Was ist Standard -Elektrodenpotential
4. Seite für Seitenvergleich -Einzelelektrodenpotential gegenüber Standard -Elektrodenpotential in tabellarischer Form
5. Zusammenfassung
Was ist ein einzelnes Elektrodenpotential?
Ein einzelnes Elektrodenpotential ist das Potenzial einer halben Zelle einer elektrochemischen Zelle. Eine elektrochemische Zelle enthält zwei halbe Zellen. Im Allgemeinen ist jede halbe Zelle eine Metallelektrode. Diese Metalle füllen ihre Ionen in den Elektrolyten (die Lösung, in die die Elektroden eintauchen), wenn es einen offenen Stromkreis gibt. Daher kann diese Elektrode ein elektrisches Potential um sich selbst entwickeln. Somit ist es das, was wir als einzelnes Elektrodenpotential bezeichnen.

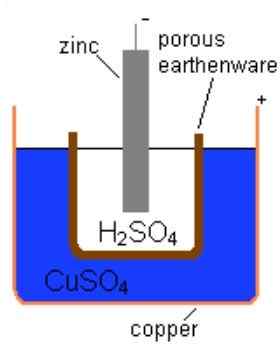
Abbildung 01: Eine Daniel -Zelle
Zum Beispiel ist die Anode in einer Daniel -Zelle Zink und die Kathode ist Kupfer. Hier entwickelt der Anode eine negative Ladung, während die Kathode eine positive Ladung entwickelt. Diese Ladungen bestimmen einzeln das einzelne Elektrodenpotential dieser Elektroden. Darüber hinaus gibt es drei Faktoren, von denen dieses Potential abhängt. Ionenkonzentration in der Lösung, Tendenz zur Bildung von Ionen und Temperatur.
Was ist Standard -Elektrodenpotential
Standard -Elektrodenpotential ist das Potenzial einer halben Zelle bei Standardbedingungen. In einer elektrochemischen Zelle wird der Elektrizität durch die Potentialdifferenz zwischen zwei Elektroden erzeugt. Es gibt keine Möglichkeit, das Elektrodenpotential einfach und genau zu messen. Darüber hinaus variiert es mit Temperatur, Konzentration und Druck des Systems. Daher müssen wir ein Standard -Elektrodenpotential definieren.
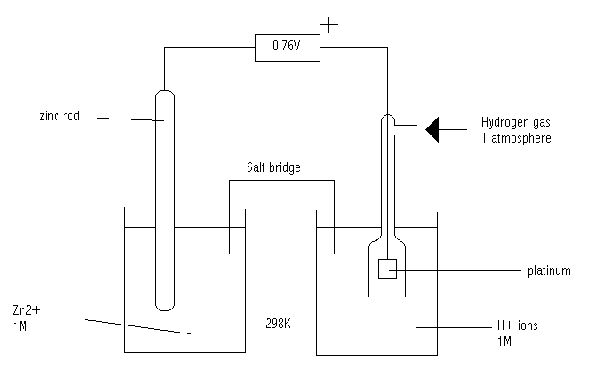
Abbildung 02: Standard -Elektrodenpotential von Zink
Das Standard-Elektrodenpotential ist das Potential einer Elektrode bei 1-Atmosphärendruck, 25 ° C-Temperatur und 1 m molarer Ionenkonzentration im Elektrolyten. Da wir das individuelle Elektrodenpotential nicht messen können, messen wir diesen Standardwert gegen Standard -Wasserstoffelektrodenpotential.
Was ist der Unterschied zwischen einem einzelnen Elektrodenpotential und dem Standard -Elektrodenpotential?
Eine elektrochemische Zelle enthält zwei Elektroden, die als halbe Zellen bekannt sind. Das elektrische Potential einer Elektrode ist ein einzelnes Elektrodenpotential. Wenn wir es jedoch unter Standardbedingungen messen, nennen wir es Standard -Elektrodenpotential. Der Schlüsselunterschied zwischen einem einzelnen Elektrodenpotential und dem Standard -Elektrodenpotential besteht daher darin, dass ein einzelnes Elektrodenpotential das Potential einer einzelnen Elektrode in einer elektrochemischen Zelle ist, während das Standard -Elektrodenpotential die Potentialdifferenz zwischen zwei Elektroden bei Standardbedingungen ist. Darüber hinaus sind die Standardbedingungen das Standard -Wasserstoffelektrodenpotential.
Die folgende Infografik zeigt weitere Details zum Unterschied zwischen einem einzelnen Elektrodenpotential und dem Standard -Elektrodenpotential.

Zusammenfassung -Einzelelektrodenpotential gegenüber Standard -Elektrodenpotential
Eine elektrochemische Zelle enthält zwei Elektroden. Wir nennen das Potenzial von Elektrode „Einzelelektrodenpotential“. Der Schlüsselunterschied zwischen einem einzelnen Elektrodenpotential und dem Standard -Elektrodenpotential besteht darin.
Referenz:
1. „Standard -Elektrodenpotentiale.Standard -Elektrodenpotentiale, hier verfügbar.
2. „Einzelelektrodenpotential.Brackart, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Daniel Cell" von Kurzon in englischer Wikipedia - übertragen von en.Wikipedia nach Commons von Armando-Martin mit CommonShelper (Public Domain) über Commons Wikimedia
2. "Standard -Elektrodenpotential von Zink" von Andyrendall - eigene Arbeit (Public Domain) über Commons Wikimedia


