Unterschied zwischen SiO2 und CO2

Der Schlüsselunterschied Zwischen SiO2 und CO2 ist das Das SiO2 existiert in fester Phase, während das CO2 in der gasförmigen Phase bei Standardtemperatur- und Druckbedingungen vorhanden ist.
SiO2 ist Siliziumdioxid. CO2 ist Kohlendioxid. Sowohl Silizium als auch Kohlenstoff sind die Elemente der Gruppe 14 in der Periodenschaftstabelle von Elementen. Diese beiden Oxide sind die häufigsten und stabilsten Oxide, die sie bilden. Es gibt jedoch viele Unterschiede zwischen SiO2 und CO2. Der Schlüsselunterschied zwischen SiO2 und CO2 ist die Phase, in der sie bei Standardtemperatur und Druck existieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist SiO2
3. Was ist CO2
4. Seite an Seite Vergleich - SiO2 vs CO2 in tabellarischer Form
5. Zusammenfassung
Was ist SiO2?
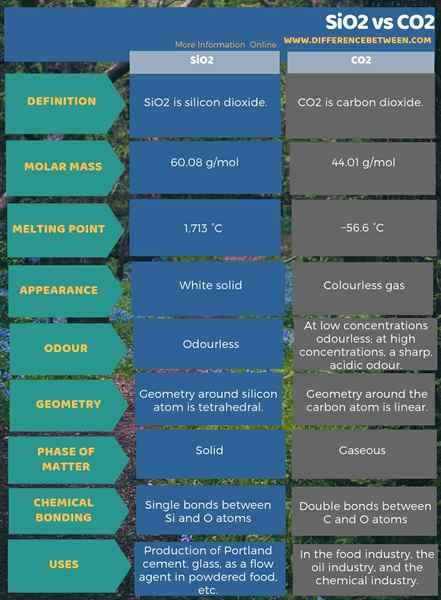
SiO2 ist Siliziumdioxid. Es ist das häufigste und stabilste Siliziumoxid. Diese Verbindung existiert in der festen Phase bei Standardtemperatur- und Druckbedingungen. Wir können es in der Natur als Quarz finden. Es existiert als Hauptbestandteil von Sand. Die Molmasse dieser Verbindung beträgt 60.08 g/mol. Es erscheint als weißer Feststoff. Die Schmelz- und Siedepunkte betragen 1.713 ° C bzw. 2.950 ° C.

Abbildung 01: Probe des Siliziumdioxids
Obwohl Siliziumatom nur zwei Sauerstoffatome gebunden ist, soll die Geometrie um das Siliziumatom tetraedrisch sein. Das liegt daran. Es gibt viele Verwendungen dieser Verbindung. Es verfügt über Anwendungen für Bauzwecke, ich.e. Produktion von Portlandzement. Außerdem ist es der Hauptbestandteil in der Glasproduktion. Außerdem ist SIO2 auch für Lebensmittel und pharmazeutische Anwendungen nützlich, i, ich.e. Als Durchflussregen in pulverisierten Lebensmitteln.
Was ist CO2?
CO2 ist Kohlendioxid und es ist das häufigste und stabilste Kohlenstoffoxid. Es existiert in der gasförmigen Phase bei Standardtemperatur- und Druckbedingungen. CO2 tritt natürlich als Kohlendioxidgas in der Atmosphäre auf (ca. 0.03%). Es ist ein farbloses Gas mit einer Dichte, die höher ist als die trockene Luft. Die Molmasse ist 44.01 g/mol. Bei niedrigen Konzentrationen ist es geruchlos, aber bei hoher Konzentration hat es einen scharfen, sauren Geruch. Der Schmelzpunkt von CO2 beträgt –56.6 ° C.

Abbildung 02: Kohlendioxidblasen in einem Erfrischungsgetränk Blasen
Dieses Molekül hat eine lineare Struktur. Die beiden Sauerstoffatome binden über Doppelbindungen an den gegenüberliegenden Seiten mit dem Kohlenstoffatom. Das Molekül hat keinen elektrischen Dipol, da es symmetrisch ist. Darüber hinaus ist diese Verbindung in Wasser löslich; Es bildet die schwache Kohlensäure. Fast alle aeroben Organismen produzieren dieses Gas in ihrer Atmung. Es hat viele Verwendungszwecke in der Lebensmittelindustrie, in der Ölindustrie und in der chemischen Industrie. Zum Beispiel ist es ein Vorläufer für viele andere Chemikalien wie Methanol. Darüber hinaus ist es ein Lebensmittelzusatz, und wir verwenden es für die Herstellung von kohlensäurehaltigen Erfrischungsgetränken. Abgesehen davon können wir Kohlendioxid verwenden, um Flammen zu löschen.
Was ist der Unterschied zwischen SiO2 und CO2?
SiO2 ist Siliziumdioxid und CO2 ist Kohlendioxid. Der Schlüsselunterschied zwischen SiO2 und CO2 besteht darin, dass das SiO2 in der festen Phase vorhanden ist, während das CO2 in der gasförmigen Phase bei Standardtemperatur- und Druckbedingungen vorhanden ist. Darüber hinaus hat Siliziumdioxid eine weiße Farbe, während Kohlendioxid eine farblose Verbindung ist.
Ein wichtiger Unterschied zwischen SiO2 und CO2 besteht darin, dass das SiO2 die tetraedrische Geometrie um Siliziumatom hat, während das CO2 die lineare Geometrie um das Kohlenstoffatom hat. Ein weiterer Unterschied zwischen SiO2 und CO2 besteht darin, dass das SiO2 einzeln.
Zusammenfassung -SiO2 vs CO2
Sowohl Silizium (SI) als auch Kohlenstoff (C) sind Elemente der Gruppe 14 in der Periodenzüchttabelle. Darüber hinaus sind die häufigsten Oxide dieser Elemente SiO2 und CO2. Der Schlüsselunterschied zwischen SiO2 und CO2 besteht darin, dass das SiO2 in der festen Phase vorhanden ist, während das CO2 in der gasförmigen Phase bei Standardtemperatur- und Druckbedingungen vorhanden ist.
Referenz:
1. Britannica, die Herausgeber von Encyclopaedia. "Kohlendioxid.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3. Januar. 2018. Hier verfügbar
2. "Siliciumdioxid.Wikipedia, Wikimedia Foundation, 19. November. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Probe von Siliziumdioxid” von Lhchem - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia
2."Soda Bubbles Makro" von Spiff (Public Domain) über Commons Wikimedia


